
【题目】在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为( )
A.1:1
B.2:1
C.1:2
D.3:2
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,其气体密度是相同条件下H2的14倍,E是一种能使溴的四氯化碳溶液褪色的乙酸酯。A、B、C、D、E在一定条件下存在如下转化关系:
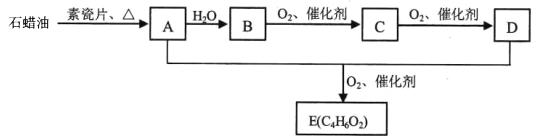
请回答:
(1)有机物C中含有的官能团名称是________ ;工业上,由石蜡油→ A的加工过程称为________。
(2)写 出 A+D+O2→ E的化学反应方程式________。
(3)下列说法不正确的是________。
A,75%(体积分数)的B溶液常用于医疗消毒
B.有机物E在 碱性条件下可发生皂化反应
C.有机物A能 与溴发生氧化反应使溴水褪色
D.用新制银氨溶液可鉴别有机物C、D、E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚![]() ,同时利用此装置的电能在铁上镀铜,下列说法正确的是
,同时利用此装置的电能在铁上镀铜,下列说法正确的是
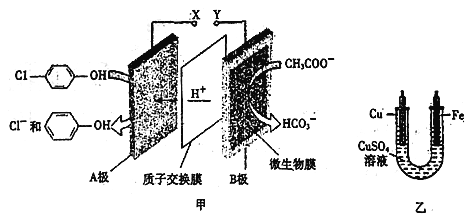
A. 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.2NA
B. A极的电极反应式为![]()
C. 铁电极应与Y相连接
D. 反应过程中甲中右边区域溶液pH逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将11.65gBaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
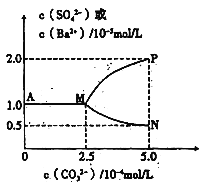
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3
D. 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元紧对应原子的M层电子排布式为________________。
(2)如下图2所示,每条折线表示周期表IVA-VIIA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是____________。
(3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为__________(填序号)。
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因__________。
(4)CO2在高温高压下所形成的晶体其晶胞如下图3所示。该晶体的熔点比SiO2晶体______(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为____________。

(5)如图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;

则:C20分子共有____个正五边形,共有______条棱边。
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断Ni2+的水合离子为______(填“有”或“无”)色离子,依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为p=5.71g/cm3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 X、Y、Z 三种元素,X 是有机化合物中必含的元素, Y 是地壳里含量最多的元素,Z 是质 量最轻的元素。X、Y、Z 三种元素组成的有机物 M 能被酸性高锰酸钾氧化生成 N。为了测定有机物 M 的结构,做如下实验:
①将 4.6 g 有机物 M 完全燃烧,测得生成 0.2mol CO2 和 5.4 g 水; ②用质谱仪检测有机物 M,得到如图 1 所示的质谱图; ③用核磁共振仪处理有机物 M,得到如图 2 所示图谱。

试回答下列问题:
(1)M 的结构简式是___________________,N 中含有的官能团的结构简式为_____________。
(2)写出 M 在铜作催化剂且加热条件下与氧气发生反应的化学方程式___________________。
(3)写出 M 与 N 在浓 H2SO4加热条件下发生反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有一种变化的反应类型与其他三种变化不同的是( )
A. CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B. CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C. 2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D. CH3CH2OH + HBr=CH3CH2Br + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。若实验中大约要使用245mL0.50 mol·L-1NaOH溶液,
(1)配制时至少需要用托盘天平称量NaOH固体_________g。
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,下列说法正确的是_________
A.如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯

B.若用50 mL 0.55 mol·L1的氢氧化钠溶液,分别与50 mL 0.50 mol·L1的盐酸和50 mL 0.50 mol·L1的硫酸充分反应,两反应测定的中和热相等
C.中和热测定实验也可以用稀硫酸与氢氧化钡溶液反应
D.为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
(3)写出该反应中和热的热化学方程式:(中和热为ΔH=-57.3 kJ·mol-1)_____________________。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①表中的温度差平均值为___________________℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH=________________(取小数点后一位)。
③上述实验数值结果与ΔH=-57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com