

| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀的pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全的pH | 3.2 | 5.2 | 8.0 |
分析 锆英砂(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)加碳酸钠熔融,ZrSiO4转化为Na2SiO3和Na2ZrO3,加过量硫酸酸浸,Na2SiO3与硫酸生成硅酸沉淀,滤液中含有ZrO2+、Fe3+、Al3+,加氨水调节pH为5.2~6.2,使Fe3+、Al3+转化为氢氧化物沉淀,过滤,滤液中主要含有ZrO2+,再加氨水调节pH使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2,以此解答该题.
解答 解:(1)烧结时ZrSiO4与碳酸钠反应生成Na2ZrO3、Na2SiO3,反应的化学方程式为ZrSiO4+2Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2ZrO3+Na2SiO3+2CO2↑,加过量硫酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣Ⅰ为H2SiO3,
故答案为:ZrSiO4+2Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2ZrO3+Na2SiO3+2CO2↑; H2SiO3 (或H4SiO4);
(2)由流程可知,调节pH=a,可分离出Fe3+、Al3+,用氨水调节pH=b,发生ZrO2++2NH3•H2O+H2O=Zr(OH)4↓+2NH4+,
故答案为:完全沉淀Fe3+、Al3+,而ZrO2+不沉淀;ZrO2++2NH3•H2O+H2O=Zr(OH)4↓+2NH4+;
(3)滤渣 II中含有氢氧化铝、氢氧化铁,制备铁红,应先除去氢氧化铝,可在滤渣 II中加足量NaOH溶液充分反应,过滤、洗净、干燥、加热分解,
故答案为:在滤渣 II中加足量NaOH溶液充分反应,过滤、洗净、干燥、加热分解;
(4)工业上用铝热法冶炼锆,方程式为3ZrO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Zr+2Al2O3,故答案为:3ZrO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Zr+2Al2O3;
(5)在原电池中,阴离子向负极移动,O2-向负极移动,负极发生氧化反应,电极反应式为CH4-8e-+4O2-=CO2+2H2O,故答案为:CH4-8e-+4O2-=CO2+2H2O.
点评 本题考查了物质分离提纯的方法和流程分析应用,为高频考点,题目涉及流程的分析应用、离子方程式的书写、除杂质、基本实验操作等,侧重于学生的分析能力和实验能力的考查,解答该类题目,注意把握实验原理和操作流程的目的,主要是物质性质的理解,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:推断题
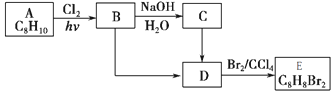
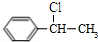 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$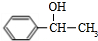 +NaCl
+NaCl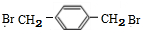 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. +
+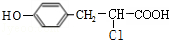 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com