
| A. | ③④ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
分析 ①氨水和硝酸银中,反应与氨水的量有关;
②氯化铝和氢氧化钠中,反应与NaOH的量有关;
③硫酸氢铵和氢氧化钡中,反应与氢氧化钡的量有关;
④硝酸和碳酸钠中,反应与硝酸的量有关.
解答 解:①氨水和硝酸银中,氨水不足生成白色沉淀,氨水过量沉淀溶解,则利用试管、滴管相互滴加观察现象可鉴别,故正确;
②氯化铝和氢氧化钠中,NaOH不足生成白色沉淀,NaOH过量沉淀溶解,则利用试管、滴管相互滴加观察现象可鉴别,故正确;
③硫酸氢铵和氢氧化钡中,氢氧化钡不足生成白色沉淀,氢氧化钡过量生成白色沉淀且有刺激性气体生成,则利用试管、滴管及闻气味可鉴别,故正确;
④硝酸和碳酸钠中,硝酸不足无现象,硝酸过量生成无色气体,则利用试管、滴管相互滴加观察现象可鉴别,故正确;
故选C.
点评 本题考查物质的鉴别,为高频考点,把握元素化合物知识及与量有关的反应为解答的关键,注意与量有关的反应中现象的差异为鉴别的依据,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有1 mol NaCl | B. | 1 mol NaCl溶于1 L水中 | ||
| C. | 58.5 g NaCl溶于941.5 g水中 | D. | 1 L溶液中含有NaCl 58.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O═4OH-+2I2 | |
| C. | 向Na2SO3溶液中滴加稀硝酸:SO32-+2H+═SO2↑+H2O | |
| D. | 用氨水吸收足量的CO2气体:OH-+CO2═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2 Br2+6Cl- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
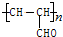 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%.
PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%. .
. +nHOCH2CH2OH$\stackrel{一定条件下}{→}$
+nHOCH2CH2OH$\stackrel{一定条件下}{→}$ +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
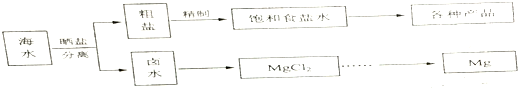
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.6 |
| Mg(OH)2 | 9.8 | 11.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com