
分析 常温下0.0001mol/LKOH溶液中c(OH-)=c(KOH)=0.0001mol/L,则c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$,pH=-lgc(H+).
解答 解:常温下0.0001mol/LKOH溶液中c(OH-)=c(KOH)=0.0001mol/L,则c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,pH=-lgc(H+)=-lg10-10=10,
答:常温下0.0001mol/LKOH溶液的pH=10.
点评 本题考查溶液pH计算,为高频考点,明确pH值计算方法是解本题关键,注意酸碱混合溶液pH的计算方法.


科目:高中化学 来源: 题型:选择题
| A. | 光导纤维中所用材料为晶体硅 | B. | 水玻璃可用作木材防火剂 | ||
| C. | 氯气可用于自来水的杀菌消毒 | D. | Fe2O3可以做油漆的颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
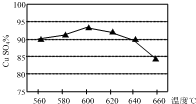 将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 973K | 1173K |
| K1 | 1.47 | 2.15 |
| K2 | 2.33 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g CO和10g N2 | B. | 10g C2H4和10g C3H6 | ||
| C. | 5.6L O2(标准状况)和0.5mol H2O | D. | 224mL He(标准状况)和1.6g CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0mol•L-1 | B. | 3.5mol•L-1 | C. | 4.0mol•L-1 | D. | 8.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑦ | B. | ②⑤⑥ | C. | ②③⑦ | D. | ④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com