
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:分析 (1)图中反应物能力大于生成物能量;
(2)根据外界条件对速率的影响分析,升温、增大压强、增大浓度、加入催化剂会加快反应速率,但注意常温下铁在浓硫酸中钝化;
(3)铜、铁、稀硫酸构成的原电池中,铁易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应.
解答 解:(1)从图象可知,反应物总能量高于生成物总能量,所以该反应为放热反应,
故答案为:放热;
(2)A.改铁片为铁粉,增大了接触面积,反应速率增大,故A正确;
B.常温下铁在浓硫酸中钝化不能继续发生反应,故B错误;
C.升高温度,反应速率增大,故C正确,故选AC,
故答案为:AC;
(3)铜、铁、稀硫酸构成的原电池中,铁易失电子发生氧化反应而作负极,负极上电极反应式为Fe-2e-=Fe2+;铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,电子由负极流向正极;
故答案为:正;有气泡产生;2H++2e-=H2↑;负;正.
点评 本题考查了影响化学反应速率因素分析、原电池原理的分析判断、原电池中电子的流向和电流方向相反,注意压强影响速率是通过改变反应物的浓度来影响的,若反应物浓度不变,则反应速率不变,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该反应中,生成物的总能量大于反应物的总能量 | |
| B. | 该反应中,断裂化学键会放出能量 | |
| C. | 乙醇的燃烧热为683.4KJ/mol | |
| D. | 反应$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(g)△H>-683.4KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
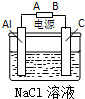 甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
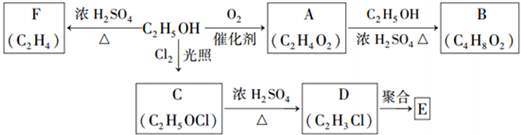
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
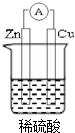 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com