
下列叙述正确的是( )
A.漂白粉和过氧化钠长期暴露在空气中最后均变质失效。
B.“低碳经济”就是要提倡大量使用煤、石油、天然气等化石燃料。
C.煤的干馏可以得到苯、甲苯等烃,不能得到衍生物。
D.只用淀粉溶液即可检验食盐是否为加碘盐。
科目:高中化学 来源: 题型:
下列叙述正确的是
A、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B、CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C、Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2
D、25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 )。
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
S-诱抗素制剂能保持鲜花盛开,S-诱抗素的分子结构
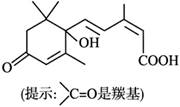 如图,下列关于该物质说法正确的是
如图,下列关于该物质说法正确的是
A. S-诱抗素制剂能发生酯化反应的官能团有2种
B. 含有苯环、羟基、羰基、羧基、碳碳双键
C. 1 mol S-诱抗素制剂与足量金属Na反应生成0.5 mol H2
D. 该化合物不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
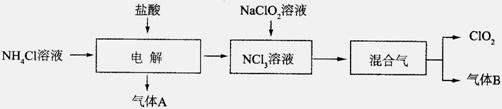 世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。
实验室制备气体B的化学方程式为
为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是 ;
②根据上述步骤可计算出原ClO2溶液的浓度为 g /L(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(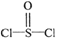 )中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响。
B.金属锂作电池的正极,石墨作电池的负极。
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3。
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:l。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A.所有的放热反应都是自发进行的
B.所有的自发反应都是放热的
C.焓变是影响反应是否具有自发性的一个重要因素
D.焓变是决定反应是否具有自发性的唯一判据
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用浓盐酸分别与KMnO4、MnO2、KClO3等多种物质在一定条件下反应制取氯气
①上述反应中,HCl表现的性质是________、________。
②在常温下,浓盐酸与KMnO4可反应生成氯气,KMnO4中的Mn被还原为+2价,该反应的化学方程式:__________________________________________________________________
________________________________________________________________________。
③KMnO4、MnO2和Cl2的氧化性由强到弱的顺序是:
________________________________________________________________________。
④已知KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,用双线桥表示该反应的电子转移情况:
________________________________________________________________________。
⑤用上述三种物质分别制取标准状况下3.36 L氯气时,转移的电子数分别是__________________(NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,在高温下不能自发进行的是( )
A.(NH4)2CO3(s)====NH4HCO3(s)+NH3(g)
B.2N2O5(g)====4NO2(g) +O2(g)
C.MgCO3(s)=====MgO(s)+CO2(g)
D.CO(g)====C(s)+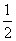 O2(g)
O2(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com