
【题目】按要求回答以下问题:
(1)写出![]() 溶液与稀硫酸反应的离子方程式___________,等物质的量的
溶液与稀硫酸反应的离子方程式___________,等物质的量的![]() 与
与![]() 固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为________。
固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为________。
(2)在![]() 稀
稀![]() 反应中,________是氧化剂;________是还原剂;氧化剂与还原剂的物质的量之比为__________
反应中,________是氧化剂;________是还原剂;氧化剂与还原剂的物质的量之比为__________
(3)向酸性高锰酸钾溶液中滴加硫酸亚铁,紫色逐渐褪去,写出该反应的离子方程式: _______。
(4)将![]() 的钠、镁、铝分别投入
的钠、镁、铝分别投入![]() 的硫酸溶液中,三者产生氢气的体积比是________。
的硫酸溶液中,三者产生氢气的体积比是________。
(5)等质量的Fe分别与足量的![]() 、S、
、S、![]() 反应转移电子数之比为_______;
反应转移电子数之比为_______;
【答案】HCO3—+H+=CO2↑+H2O 1:2 HNO3 Cu 2:3 5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O 3:2:2 9:6:8
【解析】
(1)碳酸氢钠溶液与稀硫酸反应生成硫酸钠、二氧化碳和水,碳酸钠固体与稀硫酸反应生成硫酸钠、二氧化碳和水,由方程式可知等物质的量的![]() 与
与![]() 固体消耗硫酸的物质的量之比;
固体消耗硫酸的物质的量之比;
(2)由题给方程式可知,氮元素化合价降低被还原,HNO3为氧化剂,铜元素化合价升高被氧化,Cu为还原剂;
(3)酸性高锰酸钾溶液中与硫酸亚铁反应生成硫酸锰、硫酸铁和水;
(4)0.3mol钠、镁、铝分别与酸完全反应消耗氢离子的物质的量为0.3mol、0.6mol、0.9mol,100ml1mol/L硫酸溶液中氢离子的物质的量为0.2mol,由方程式可知三种金属均过量,但过量的钠能与水反应;
(5)Fe与足量的氯气、硫和水蒸气反应分别生成氯化铁、氯化亚铁和四氧化三铁。
(1)碳酸氢钠溶液与稀硫酸反应生成硫酸钠、二氧化碳和水,反应的离子方程式为HCO3—+H+=CO2↑+H2O;碳酸钠固体与稀硫酸反应生成硫酸钠、二氧化碳和水,反应的离子方程式为CO32—+2H+=CO2↑+H2O,则等物质的量的![]() 与
与![]() 固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为1:2,故答案为:HCO3—+H+=CO2↑+H2O;1:2;
固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为1:2,故答案为:HCO3—+H+=CO2↑+H2O;1:2;
(2)由题给方程式可知,氮元素化合价降低被还原,HNO3为氧化剂,铜元素化合价升高被氧化,Cu为还原剂,氧化剂与还原剂的物质的量之比为2:3,故答案为:HNO3;Cu;2:3;
(3)酸性高锰酸钾溶液中与硫酸亚铁反应生成硫酸锰、硫酸铁和水,反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O;
(4)0.3mol钠、镁、铝分别与酸完全反应消耗氢离子的物质的量为0.3mol、0.6mol、0.9mol,100ml1mol/L硫酸溶液中氢离子的物质的量为0.2mol,由方程式可知三种金属均过量,但过量的钠能与水反应,则三者生成氢气的物质的量比为0.3mol×![]() :0.2mol×
:0.2mol×![]() :0.2mol×
:0.2mol×![]() =3:2:2,故答案为:3:2:2;
=3:2:2,故答案为:3:2:2;
(5)Fe与足量的氯气、硫和水蒸气反应分别生成氯化铁、氯化亚铁和四氧化三铁,则等质量的Fe与足量的氯气、硫和水蒸气反应转移电子数之比为3:2:![]() =9:6:8,故答案为:9:6:8。
=9:6:8,故答案为:9:6:8。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
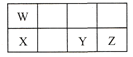
A.原子半径大小:X > Y > Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性: Z > Y > W
D.Y能形成H2Y、H2YO4的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,仅X、Y处于同周期,Y是地壳中含量最高的元素,Z的原子序数是X的两倍,X与Y形成的化合物可与Z的单质反应生成X的单质。下列说法正确的是( )。
A.简单离子的半径:![]()
B.简单氢化物的热稳定性:![]()
C.W与Y形成的化合物只含有极性共价键
D.Z的最高价氧化物对应的水化物为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32gNa2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况) 关系如图所示,下列说法中错误的是( )
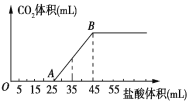
A.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-
B.A点溶液中的溶质为NaCl、NaHCO3
C.混合物中NaOH的质量0.60g
D.当加入35mL盐酸时,产生CO2的体积为224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种零价铁纳米簇可用于水体修复,其处理三氯乙烯(![]() )所形成原电池如图所示。水体中
)所形成原电池如图所示。水体中![]() ,
,![]() ,
,![]() 等离子也发生反应。下列说法正确的是( )
等离子也发生反应。下列说法正确的是( )
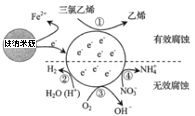
A.零价铁纳米簇发生的电极反应为:Fe-3e-=Fe3+
B.反应①在正极发生,反应②③④在负极发生
C.③的电极反应式为4OH--4e-=O2↑+2H2O
D.三氯乙烯脱去3mol Cl时反应①转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL和V2 mL(已折算到标准状况下)。
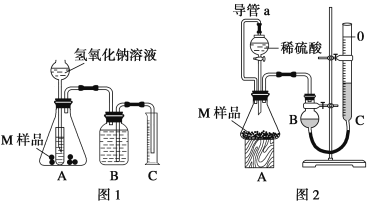
(1)写出实验1中可能发生反应的离子方程式:____________。
(2)该实验需要0.50 mol·L-1的NaOH溶液480 mL,请回答下列问题:
①配制时应用托盘天平称量______g NaOH,应选择________ ml容量瓶。
②配制NaOH溶液时,NaOH固体中含有Na2O杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(3)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3)配制的,则该浓硫酸的物质的量浓度是_______。
(4)对于实验2,读数时冷却至室温除视线平视外,还应进行的操作是: ___________。
(5)实验2中导管a的作用_________。
(6)M样品中铜的质量的数学表达式为(用V1和V2 表示):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是( )
的叙述错误的是( )
A. 原子序数116B. 中子数177
C. 核外电子数116D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 资源化利用的方法之一是合成二甲醚(
资源化利用的方法之一是合成二甲醚(![]() 简写做
简写做![]() )。
)。![]() 催化加氢法合成
催化加氢法合成![]() ,其过程中主要发生下列反应:
,其过程中主要发生下列反应:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
其中,反应Ⅱ分以下两步完成,请写出反应Ⅳ的热化学方程式。
反应Ⅲ:![]()
![]()
反应Ⅳ:___________。
⑴反应Ⅳ的热化学方程式为________。
⑵在![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 的平衡转化率和平衡时
的平衡转化率和平衡时![]() 、
、![]() 的选择性随压强或温度的变化见下图。已知:
的选择性随压强或温度的变化见下图。已知:
![]() 的选择性
的选择性![]() ;
;
![]() 的选择性
的选择性![]()
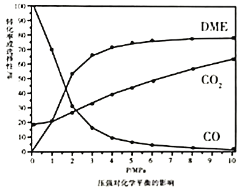
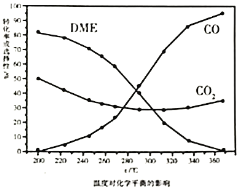
①依据图像中的数据分析,提高平衡时![]() 的选择性应当选择的条件为________。
的选择性应当选择的条件为________。
A 高温高压 B 低温低压 C 高温低压 D 低温高压
按照温度对化学平衡的影响图像分析温度低于300℃,![]() 平衡转化率随温度升高而降低的原因是_______。
平衡转化率随温度升高而降低的原因是_______。
②某温度和压强下,起始投入![]() 与足量
与足量![]() 发生反应,达到平衡时
发生反应,达到平衡时![]() 的转化率为40%,部分物质的物质的量如下表:
的转化率为40%,部分物质的物质的量如下表:
|
|
|
|
|
|
计算平衡时![]() 的选择性为________,反应Ⅳ的化学平衡常数为________。
的选择性为________,反应Ⅳ的化学平衡常数为________。
⑶经研究发现,在不同反应条件下反应相同时间(未平衡)测定发现,体系中![]() 的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
⑷![]() ,投料比为
,投料比为![]() 时进行反应,
时进行反应,![]() 的浓度随时间变化如下图所示,则下列说法正确的为________。
的浓度随时间变化如下图所示,则下列说法正确的为________。
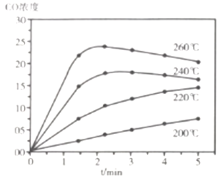
A 在![]() 范围内,反应Ⅰ的速率随温度升高而增大
范围内,反应Ⅰ的速率随温度升高而增大
B 200℃条件下,随反应时间的延长,![]() 的浓度始终增大
的浓度始终增大
C 260℃条件下,随反应时间的延长,![]() 的浓度先增大后减小最终不变
的浓度先增大后减小最终不变
D 260℃条件下,![]() 后
后![]() 的浓度减小是因为随时间推移反应Ⅱ的进行使体系中
的浓度减小是因为随时间推移反应Ⅱ的进行使体系中![]() 浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使
浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使![]() 浓度逐渐下降
浓度逐渐下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com