
| A. | ①②⑤ | B. | ①③④ | C. | ②③⑤ | D. | ①③④⑥ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 | |
| B. | 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸 | |
| C. | 可以利用银镜反应证明反应①的最终产物为葡萄糖 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 | 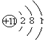 | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| B. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、CH3COO-、NO3- | |
| D. | 由水电离的c(H+)=1×10-12 mol•L-1的溶液中:Ba2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
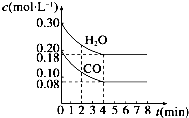 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H<0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30mol CO、0.10mol H2O、0.20mol CO2和20mol H2,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L | B. | 1.12 L | C. | 0.672 L | D. | 0.448 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 在1L 0.5 mol/L的盐酸加入1.5 mol/L盐酸1L | |
| D. | 从1000mL 1mol/LNaCl溶液中取出100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,溶液中c(OH-)增大 | |
| D. | 降低温度,溶液中c(NH4+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
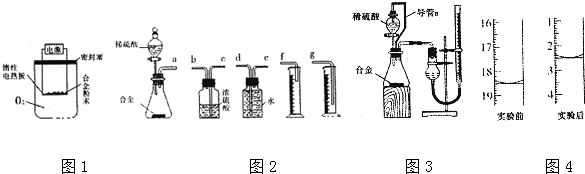
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com