
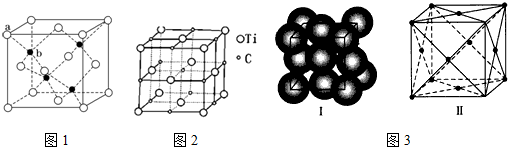
分析 (1)根据硫化锌的晶胞图可知,根据均摊法计算出晶胞中含有硫离子数,每个硫离子周围距离最近的锌离子有4个,而每个锌离子周围距离最近的硫离也是4个,据此答题;
(2)气态团簇分子中原子不用均摊法计算,而是直接数各原子个数,进而确定化学式;
(3)碳正离子CH3+中碳原子的价层电子对数为$\frac{4+3-1}{2}$=3,碳负离子CH3-中碳原子的价层电子对数为$\frac{4+3+1}{2}$=4,有一对孤电子对,据此判断键角和空间构型;
(4)晶胞的边长为a pm,则晶胞的体积为(a×10-10)3cm3,根据晶胞的结构可知,晶胞中含有原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$ρ=\frac{\frac{4M}{{N}_{A}}}{V}$可计算出NA.
解答 解:(1)根据硫化锌的晶胞图可知,晶胞中含有硫离子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,每个锌离子周围距离最近的硫离是4个,
故答案为:4;4;
(2)根据晶胞结构可知,晶胞中含有钛原子为14,碳原子数为13,所以化学式为Ti14C13,
故答案为:Ti14C13;
(3)碳正离子CH3+中碳原子的价层电子对数为$\frac{4+3-1}{2}$=3,所以CH3+中C-H键键角是120°,碳负离子CH3-中碳原子的价层电子对数为$\frac{4+3+1}{2}$=4,有一对孤电子对,所以CH3-的空间构型是三角锥形,
故答案为:120°;三角锥形;
(4)晶胞的边长为a pm,则晶胞的体积为(a×10-10)3cm3,根据晶胞的结构可知,晶胞中含有原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$ρ=\frac{\frac{4M}{{N}_{A}}}{V}$可知,NA=$\frac{4M}{ρV}$=$\frac{4M}{ρ(a×10{\;}^{-10})^{3}}$mol-1=$\frac{4M×1{0}^{30}}{ρ{a}^{3}}$mol-1,
故答案为:$\frac{4M×1{0}^{30}}{ρ{a}^{3}}$.
点评 本题考查了较综合,涉及粒子空间构型判断、均摊法的运用、键角的判断、晶胞计算等知识,需要学生具备一定的空间想象与数学计算能力,难度中等,答题时注意根据价层电子对互斥理论、元素周期律等知识点来分析解答.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2L溶液中阴、阳离子总数为1.2NA | |
| B. | 100mL溶液中NO3-物质的量为为0.4mol | |
| C. | 200mL溶液中Mg2+浓度为0.2mol•L-1 | |
| D. | 500mL溶液中NO3-总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
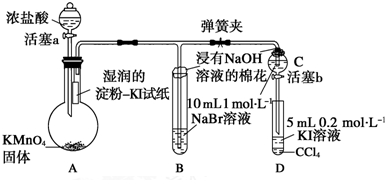
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=-178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| B. | △H1=178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=78.3kJ•mol-1 | |
| D. | △H1=178.32kJ•mol-1△H2=78.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | ≧3:1的任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上层为紫色液体,下层为无色液体 | B. | 上层为无色液体,下层为紫色液体 | ||
| C. | 均为紫色液体 | D. | 上层为橙色液体,下层为无色液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 电镀铜时,阳极的反应式:Cu2++2e-═Cu | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-,Cl-,Na+,NH4+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,CO32-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com