
| 1 |
| 2 |
 ;△H1
;△H1| 1 |
| 2 |
 ;△H1
;△H1 +
+| 5 |
| 2 |
 +
+| 5 |
| 2 |
| b |
| 2 |
(a+
| ||
| 2 |
(a+
| ||
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
| A、CH3OH的起始浓度为1.64 mol/L |
| B、此时逆反应速率小于正反应速率 |
| C、平衡时,CH3OH的浓度为0.04 mol/L |
| D、平衡时,CH3OH的转化率小于90% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、改用含有少量杂质铜的锌 |
| C、改用98%的浓硫酸 |
| D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鸡蛋白溶液中加入硫酸铵溶液变浑浊 |
| B、用福尔马林溶液浸泡动物标本 |
| C、用波尔多液(含CuSO4等)防治作物病虫害 |
| D、医院用加热法消毒医疗器械 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的分馏、煤的气化、海水提溴过程都包含化学变化 |
| B、地沟油经处理后可作为汽车燃油,故地沟油成分是液态烃 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、乙烯和苯都能使溴水褪色,且褪色的原因相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
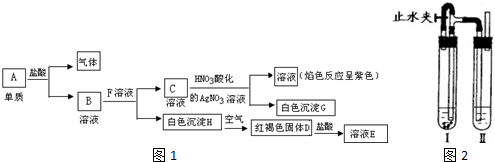
查看答案和解析>>
科目:高中化学 来源: 题型:
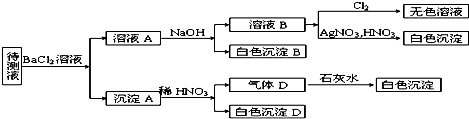
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com