
| A、1 mol Na2O2中含有的阴离子数为0.2NA |
| B、标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NA |
| C、常温常压下,8g O3含有4 NA个电子 |
| D、常温下,1L pH=2的H2SO4溶液中含有的H+数目为0.02NA |
| V |
| 22.4L/mol |
| m |
| M |
| N |
| NA |
| V |
| 22.4L/mol |
| 2.24L |
| 22.4L/mol |
| m |
| M |
| 8g |
| 3×16g/mol |
| 1 |
| 6 |
| 1 |
| 6 |
| N |
| NA |


科目:高中化学 来源: 题型:
| A、醋酸钠溶液pH>7 |
| B、醋酸溶液能溶解碳酸钙 |
| C、0.1mol?L-1醋酸溶液pH=2.9 |
| D、pH=1的醋酸溶液稀释100倍后pH<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2与过量的镁铁反应,转移2NA个电子 |
| B、常温下,16g CH4含有8NA个电子 |
| C、1L 0.5mol?L-1 Na2SO4溶液中含有NA个SO42- |
| D、常温常压下,22.4L CO2含有NA个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在田间焚烧秸秆,增加草木灰肥料 |
| B、大量开采地下水,以满足生产、生活的需求 |
| C、用“复合石头纸”替代木浆纸,减少树木砍伐 |
| D、尽可能多的使用各种添加剂,改善食品的品质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石溶于盐酸中:CO32-+2H+=CO2↑+H2O |
| B、将氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O |
| C、铁粉加入氯化铁溶液中:Fe+Fe3+=2Fe2+ |
| D、二氧化碳通入氯化钙溶液中:CO2+H2O+Ca2+=CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液中:Al3+、Cu2+、SO42-、Cl- |
| B、由水电离的c(H+)=1×10-12 mol?L-1的溶液中:Ba2+、K+、Cl-、NO3- |
| C、c(OH-)/c(H+)=1012的溶液中:Na+、Mg2+、NO3-、Cl- |
| D、加入铝单质能放出氢气的溶液中:Mg2+、NH4+、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 原溶液中含有Fe2+和Fe3+ |
| C | 将铜片放入浓硝酸中 | 产生大量红棕色气体,溶液变为蓝绿色 | 浓硝酸有强氧化性和酸性 |
| D | 向Na2SiO3溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 酸性:硅酸>盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
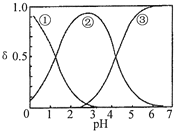 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )| A、曲线①代表的粒子是HC2O4- |
| B、0.1 mol?L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| C、pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| D、一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com