
| A. | HCO3- | B. | Cl- | C. | NH4+ | D. | Cu2+ |
科目:高中化学 来源: 题型:选择题
 臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )
臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )| A. | 反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△S<0 | |
| B. | 曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb | |
| C. | 曲线b对应的条件改变可能是密闭容器的体积变为4.0 L | |
| D. | 若c1=0.3mol•L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡后,缩小容器的容积,N2的浓度增大 | |
| B. | 平衡后,再向容器中充入1mol氦气,N2的转化率增大 | |
| C. | 平衡前,随着反应的进行,容器内气体密度逐渐增大 | |
| D. | 平衡时,该反应放出的热量为92.4kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba( OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的炭与CO2反应 | D. | 甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| A | 简单氢化物能与其最高价含氧酸反应生成盐 |
| B | 原子最外层电子数是其电子层数的3倍 |
| C | 周期表中非金属性最强的元素 |
| D | 与C位于同主族,且都为短周期元素 |
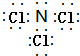 .X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.
.X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化铝(AIN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al203在
氮化铝(AIN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al203在查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )| A. | 从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率 | |
| B. | c点切线的斜率表示该化学反应在t时刻的瞬时速率 | |
| C. | 在不同时刻都存在关系:3v(N2)=v(CO) | |
| D. | 维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com