
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热ΔH为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②CO将NO2还原为单质的热化学方程式为 ________________。
(2)图是一种用NH3脱除烟气中NO的原理。
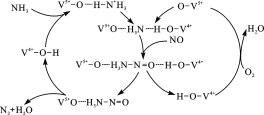
①该原理中,NO最终转化为H2O和_______(填化学式)。
②当消耗1 mol NH3和0.5 mol O2时,除去的NO在标准状况下的体积为____L。
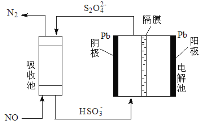
(3)间接电化学法,如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式_____________。用离子方程式表示吸收池中除去NO的原理_______。
【答案】-283kJ/mol 631.75 2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol N2 11.2 2HSO3-+2e-+2H+=S2O42-+2H2O 2NO+2S2O42-+2H2O=N2+4HSO3-
【解析】
(1) ①由①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1可知, 2molCO完全燃烧放出566.0 kJ的热量,所以1molCO完全燃烧放出283kJ的热量,所以CO的燃烧热ΔH为-283kJ/mol;若1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,设1 mol NO(g)分子中化学键断裂时需吸收的能量为x,由②N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ·mol1可知, 2molCO完全燃烧放出566.0 kJ的热量,所以1molCO完全燃烧放出283kJ的热量,所以CO的燃烧热ΔH为-283kJ/mol;若1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,设1 mol NO(g)分子中化学键断裂时需吸收的能量为x,由②N2(g)+O2(g) ![]() 2NO(g) ΔH=946k +498k-2x=+180.5,解之得x=631.75 ,所以1 mol NO(g)分子中化学键断裂时需吸收的能量为631.75kJ;
2NO(g) ΔH=946k +498k-2x=+180.5,解之得x=631.75 ,所以1 mol NO(g)分子中化学键断裂时需吸收的能量为631.75kJ;
②由①2CO(g)+O2(g) ![]() 2CO2(g) ΔH1=566.0 kJ·mol1
2CO2(g) ΔH1=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH2=+180.0 kJ·mol1
2NO(g) ΔH2=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH3=116.5 kJ·mol1
2NO2(g) ΔH3=116.5 kJ·mol1
①![]() 2-②-③可得: 2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=(-566.0kJ/mol)
2-②-③可得: 2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=(-566.0kJ/mol)![]() 2-(+ 180.5kJ/mol)-( -116.5 kJ/mol)=-1196kJ/mol , 所以CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol;
2-(+ 180.5kJ/mol)-( -116.5 kJ/mol)=-1196kJ/mol , 所以CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol;
(2) ①由脱硝原理确定从体系中分离出的物质为生成物,分别为N2和H2O;
②由电子得失相等计算:O2~2O2-,得电子4mol,0.5mol氧气反应得到电子2mol; 2NO~N2失电子4mol,当失去电子2mol时,有0.5mol氮气生成 标况下体积是11.2L;
(3)根据电解池中阳极氧化、阴极还原,阴极发生还原反应,根据图示,亚硫酸氢根离子得电子生成连二亚硫酸根离子,电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O;连二亚硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-。


科目:高中化学 来源: 题型:
【题目】用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,该电极反应可能的机理如下图所示。下列说法正确的是
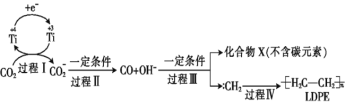
A. 含![]() 的-极与电源负极相连
的-极与电源负极相连
B. 过程Ⅰ、Ⅱ中碳元素均被还原,过程Ⅲ中碳元素被氧化
C. 电解过程中CO![]() 向阴极迁移
向阴极迁移
D. 工业上生产1.4×104 g的LDPE,转移电子的物质的量为6×103 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天的游客佩戴变色眼镜来保护眼睛的镜片是陶瓷的
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A. ①②③ B. ②④ C. ③④⑤ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.6gCu和Cu2O组成的混合物加入250 mL—定浓度的稀硝酸中,固体完全溶解生成Cu(NO3)2和NO。向所得溶液中加入1.0 L 0.5 mol L-1的NaOH溶液,生成沉淀的质量为19.6 g,此时溶液呈中性,且金属离子(钠离子除外)沉淀完全。下列说法正确的是
A. 原固体混合物中,Cu和Cu2O的物质的量之比为1:1
B. 原稀硝酸的浓度为1.3 mol·L-1
C. 固体溶解后剩余硝酸的物质的量为0.1 mol
D. 产生的NO的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明BeCl2是共价化合物的实验事实是( )
A. BeCl2的水溶液能导电B. BeCl2的水溶液显酸性
C. BeCl2在熔融状态下不导电D.在高温时有BeCl2分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
B. 25 ℃与60 ℃ 时,水的pH相等
C. 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等
D. 2SO2(g)+O2(g)![]() 2SO3(g)和4SO2(g)+2O2(g)
2SO3(g)和4SO2(g)+2O2(g)![]() 4SO3(g)的ΔH相等
4SO3(g)的ΔH相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 2.0 g重水(2H2O)中含有的质子数为10NA
B. 50mL 18.4 molL-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
C. 分子数为NA的N2、C2H4混合气体体积约为22.4 L,质量为28 g
D. 标准状况下,22.4LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
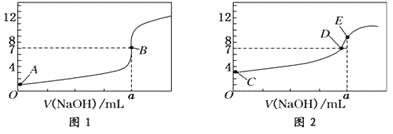
以HA表示酸,下列说法正确的是( )
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C. 达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D. 当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
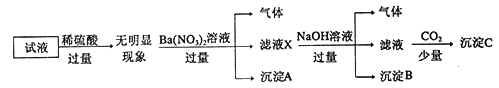
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com