
【题目】下列物质的转化在给定条件下能实现的是( )
①![]()
②![]()
③![]()
④![]()
A.①③B.①④C.②③D.②④
【答案】A
【解析】
①Al2O3是两性氧化物,能够与NaOH反应产生NaAlO2,由于碳酸的酸性比Al(OH)3强,向NaAlO2溶液中通入CO2气体,会发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,能够实现给定物质的转化,①正确;
②S与O2点燃产生SO2,不能产生SO3,因此不能实现给定物质的转化,②错误;
③向饱和NaCl溶液中先通入NH3使溶液显碱性,然后再通入CO2气体,发生反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将NaHCO3过滤,然后加热发生分解反应:2NaHCO3![]() Na2CO3+H2O+CO2↑,制取得到Na2CO3,能够实现给定物质的转化,③正确;
Na2CO3+H2O+CO2↑,制取得到Na2CO3,能够实现给定物质的转化,③正确;
④Fe2O3与HCl发生反应产生FeCl3溶液,在FeCl3溶液中发生水解反应产生HCl和Fe(OH)3,加热HCl挥发促进盐的水解,得到Fe(OH)3固体,Fe(OH)3受热分解产生Fe2O3,不能得到无水FeCl3,因此不能实现给定物质的转化,④错误;
综上所述可知:能够实现物质转化的序号是①③,故合理选项是A。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列说法正确的是
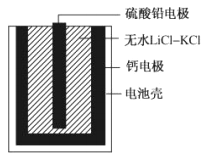
A. 放电过程中,Li+向负极移动
B. 正极反应式:Ca+2Cl-—2e-=CaCl2
C. 每转移0.1mol电子,理论上生成10.35gPb
D. 常温时,在正负极间接上电流表或检流计,指针偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性:Cl2>IO3->Fe3+>I2,则对实验结果分析或预测正确的是( )
A.加碘食盐溶液中滴入少量白醋和淀粉 KI 溶液,溶液变蓝色,说明可能是 IO![]()
B.加碘食盐溶液中加入过量氯水后加淀粉,溶液不变蓝色,说明不可能是 I-
C.FeI2 溶液中滴加少量氯水,溶液中一定有 Fe3+生成
D.FeCl2 溶液中滴加足量碘水和 KSCN 溶液,溶液一定变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b为等质量的电极,电解槽中盛有1 L 1.0 mol·L-1CuSO4溶液,电解前后溶液体积变化忽略不计,下列有关叙述正确的是
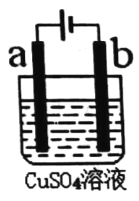
A.电子的流向:负极→b→a→正极
B.若为电解精炼铜装置,则a为粗铜;若为电镀铜装置,则b为纯铜
C.电镀铜或电解精炼铜,溶液中Cu2+浓度均不变
D.若为电镀铜,当电路中通过的电子为0.2mol时,两极的质量相差12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应速率的说法中,正确的是
A.决定化学反应速率的因素是反应物本身的性质
B.对反应C(s)+CO2(g)![]() 2CO(g),其他条件不变时,增加C的量能使反应速率增大
2CO(g),其他条件不变时,增加C的量能使反应速率增大
C.其他条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D.如图实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
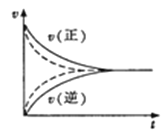
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn,发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
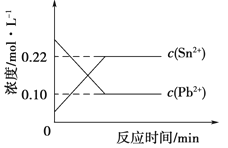
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应正反应是吸热反应
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近罗格斯大学研究人员利用电催化技术高效率将CO2转化为X和Y(如下图), X、Y可用作制备塑料、粘合剂和药品的前体等。下列说法正确的是
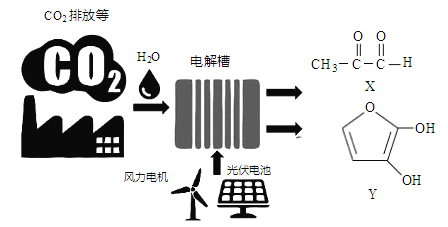
A. 图中能量转换方式只有2种
B. X、Y分子中所含的官能团相同
C. X、Y均是电解时的阳极产物
D. CO2资源化利用有利于解决大气中CO2浓度增加导致的环境问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2.3克某有机物在氧气中完全燃烧,只生成4.4克二氧化碳和2.7克水。
(1)计算确定该有机物的最简式________。
(2)若该有机物的相对分子质量为46,写出其分子式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____(填“放热”或“吸热”)反应。
②乙容器在50min时达到平衡状态,则NO的浓度是______,0~50min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、C两点的浓度平衡常数关系:Kc(A)_______Kc(C)(填“<”、“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”、“B”或“C”)点。
③计算B点时该反应的压强平衡常数Kp(B)=________(Kp是用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com