
分析 (1)根据n=cV、m=nM计算出需要氯化钠的质量,注意托盘天平的最小读数为0.1g;
(2)加水至刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
(3)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)容量瓶只有一个刻度.
解答 解:(1)没有90mL的容量瓶,应配制100mL溶液,100mL、1mol/L的NaCl中含有氯化钠的质量为:58.5g/mol×1mol/L×0.1L=5.85g,托盘天平最小读数为0.1g,需要称量5.9g氯化钠,左码右物时,实际物质的质量=砝码-游码=5-0.9=4.1g,
故答案为:5.9;4.1;
(2)加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切,故答案为:加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
(3)A.容量瓶未干燥即用来配制溶液,都溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变;
B.NaCl已潮湿称取氯化钠的质量偏小,浓度偏低;
C.部分溅出,溶质的物质的量减小,浓度偏低;
D.定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏小;
E.称量用了生锈的砝码,导致称取的溶质的质量偏大,溶质的物质的量偏大,溶液的浓度偏大;
故答案为:DE;
(4)容量瓶只有一个刻度,应选用100mL的容量瓶,故答案为:100mL.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,注意掌握配制一定物质的量浓度的溶液步骤,(1)为易错点,注意托盘天平的最小读数为0.1g.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c({H}^{+})}$>1.0×10-7mol/L | |
| B. | 往滤液中加水稀释,所有离子浓度都会减小 | |
| C. | c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
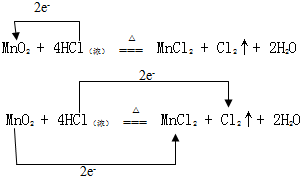 实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2CO3>H2SiO3 | B. | 稳定性:HF<H2O<NH3 | ||
| C. | 离子半径:Na+>F->Al3+ | D. | 沸点:HI>HBr>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中MnO2作催化剂 | B. | 盐酸未反应完 | ||
| C. | 被还原的HCl少于0.2mol | D. | 反应产生2.24L氯气(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO${\;}_{3}^{-}$ | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=5:1时,铝元素以AlO${\;}_{2}^{-}$形式存在 | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,溶液中只有Fe3+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$ CO+H2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
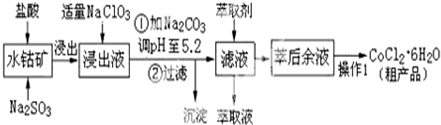
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com