
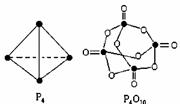
白磷与氧可发生如下反应:P4+5O2=== P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的 H,其中正确的是
H,其中正确的是
A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
常温下,pH=3的HA溶液V1 mL与pH=11的KOH溶液V2 mL混合,则下列说法正确的是( )
A.若V1=V2,则反应后溶液的pH一定等于7
B.若反应后溶液呈酸性,则V1一定小于V2
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈中性,则混合液中一定存在c(H+)+c(OH-)=2×10-7 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法中正确的是
A.溶液中Ca2+数目减少 B.溶液中c(Ca2+)增大
C.溶液的pH增大 D.溶液中溶质的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②浓硫酸可用于干燥氨气、二氧化氮气体
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
A.①④⑤ B.①⑤ C.②③④ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体.D的俗名叫铁红,A是形成酸雨的主要气体。则:
(1)在周期表中,组成单质I的元素位于第 周期 族;
(2)写出S2-的离子结构示意图: ;写出N2的结构式: ;
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应是 ;(填写序号)
(4)反应④的离子方程式是: 。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.反应:SiO2+Na2CO3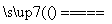 Na2SiO3+CO2↑,说明H2SiO3的酸性大于H2CO3的酸性
Na2SiO3+CO2↑,说明H2SiO3的酸性大于H2CO3的酸性
B.可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
C.二氧化硅是生产光导纤维、玻璃的基本原料
D.CO2、CH4、N2是温室气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是 ( )
A.石英与烧碱反应:SiO2+2OH-===SiO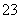 +H2O
+H2O
B.硅与烧碱反应:Si+2OH-===SiO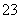 +H2↑
+H2↑
C.硅酸钠溶液中通入少量CO2:SiO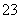 +CO2+H2O===CO
+CO2+H2O===CO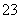 +H2SiO3↓
+H2SiO3↓
D.往水玻璃中加入盐酸:2H++SiO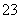 ===H2SiO3↓
===H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO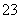 、NO
、NO 、SO
、SO 、SiO
、SiO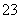 。
。
现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得滤液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水中一定含有的离子是___________________________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是_________________________________________________________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为14,其离子方程式为Al+NO +OH-―→AlO
+OH-―→AlO +NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO
+NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO ,要消耗铝________g。
,要消耗铝________g。
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。下列处理措施和方法中正确的是________。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com