
| A、11与17 | B、11与10 |
| C、1与17 | D、1与8 |


科目:高中化学 来源: 题型:
| A、用分液的方法分离水和四氯化碳 |
| B、用分液的方法分离植物油和汽油 |
| C、用过滤的方法分离酒精和水 |
| D、用过滤的方法分离四氯化碳和碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A、元素X和Q形成的化合物中不可能含有共价键 |
| B、Q2-比R3-更容易失去电子 |
| C、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| D、M(OH)2的碱性比XOH的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯环是单、双键交替组成的平面环状结构 | |||
| B、苯和乙烯均能使酸性KMnO4溶液褪色 | |||
C、苯的硝化反应:
 属于取代反应 属于取代反应 | |||
| D、苯跟溴水在催化剂作用下发生取代反应生成溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)常温下,将三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
(1)常温下,将三种一元酸分别和NaOH溶液等体积混合,实验数据如下:| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH=7 |
| 丙 | c(HZ)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH=b |
查看答案和解析>>
科目:高中化学 来源: 题型:
13 6 |
12 6 |
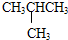
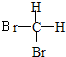 和
和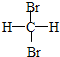 E.CH4和CH3(CH2)2CH3
E.CH4和CH3(CH2)2CH3查看答案和解析>>
科目:高中化学 来源: 题型:
 在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com