
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
分析 氨水存在电离平衡NH3•H2O?NH4++OH-,要想增大NH4+的浓度,而不增大OH-的浓度,则加入的物质必须含有铵根离子或含有能和氢氧根离子反应的离子,据此分析解答.
解答 解:①适当升高温度,平衡正向移动,c(NH4+)增大,c(OH-)增大,故①错误;
②加入氯化铵固体,c(NH4+)增大,平衡逆向移动,c(OH-)减小,故②正确;
③向氨水中通入氨气,c(NH4+)增大,c(OH-)增大,故③错误;
④加入少量盐酸,盐酸和氢氧根离子反应生成水,促进氨水电离,c(NH4+)增大,c(OH-)减小,故④正确;
故选D.
点评 本题考查弱电解质电离,加入含有铵根离子或氢氧根离子的物质能抑制氨水电离,加入和铵根离子或氢氧根离子反应的物质能促进氨水电离,难度不大.


科目:高中化学 来源: 题型:填空题
 (1)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.Fe还原水体中NO3-的反应原理如图所示.
(1)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.Fe还原水体中NO3-的反应原理如图所示.| 化学键 | H-H | C-O | C-O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | 1075 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 碱性溶液中:Na+、ClO-、SO42-、I- | |
| C. | 0.1mol•L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1 mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2 molN2和0.3 molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
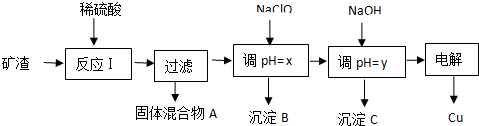
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com