
【题目】在实验室中,用下图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中。实验结果与预测的现象一致的是
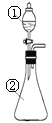
选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
A. | 氢氧化钠 | 明矾溶液 | 开始时即产生白色沉淀 |
B. | 浓硫酸 | 铜片 | 产生无色气体,溶液变蓝 |
C. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
D. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 开始时无明显现象 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
(1)氯气和氢气的反应的属于____________
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)对于反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
A.MnO2是还原剂 B.MnCl2是氧化产物
C.Cl2是氧化产物 D.H2O是还原产物
(3)下列反应条件的改变对实验室制备氯气速率的影响正确的是_____________
A.增大盐酸的浓度能加快反应速率
B.若用稀盐酸与二氧化锰反应则反应速率较慢
C.升高温度能减慢反应速率
D.增加MnO2的质量可显著加快反应速率
(4)氢气在氯气中燃烧为放热反应,下列说法正确的是________________
A.断开Cl—Cl键放出能量 B.形成H—Cl键吸收能量
C.燃烧都是放热反应 D.反应物的总能量小于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对装置的描述中正确的是
A.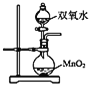 实验室中可用甲装置制取少量 O2
实验室中可用甲装置制取少量 O2
B.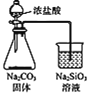 可用乙装置比较C、Si 的非金属性
可用乙装置比较C、Si 的非金属性
C.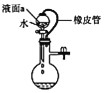 若丙装置气密性良好,则液面a保持稳定
若丙装置气密性良好,则液面a保持稳定
D.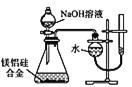 可用丁装置测定镁铝硅合金中 Mg 的含量
可用丁装置测定镁铝硅合金中 Mg 的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
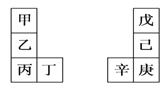
A.丙与庚的原子序数相差3
B.气态氢化物的热稳定性:戊>己>庚
C.乙所在周期元素中,其简单离子的半径最大
D.乙的单质在空气中燃烧生成的化合物只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置不能完成相应实验的是
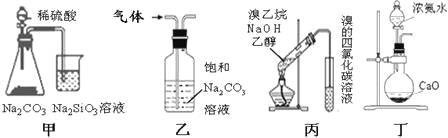
A.甲装置可比较硫、碳、硅三种元素的非金属性强弱
B.乙装置可除去CO2中少量的SO2杂质
C.丙装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯
D.丁装置可用于实验室制备氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下:
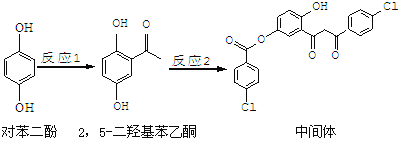
下列说法正确的是
A.对苯二酚和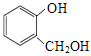 互为同系物
互为同系物
B.1 mol该中间体最多可与7 mol氢氧化钠反应
C.2,5—二羟基苯乙酮能发生加成、水解等反应
D.该中间体分子含有羰基和羟基两种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(![]() )、肼(
)、肼(![]() )和四氧化二氧(
)和四氧化二氧(![]() )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知:![]()
![]()
![]()
![]()
![]()
![]()
![]() 和
和![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式(![]() 用含
用含![]() 、
、![]() 、
、![]() 的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
(2)肼(![]() )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
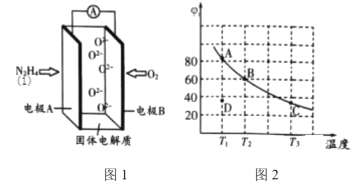
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(![]() )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________点。![]() 时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的
时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的![]() 平均反应速率为________。
平均反应速率为________。
③若其条件不变,在![]() 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量![]() ,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
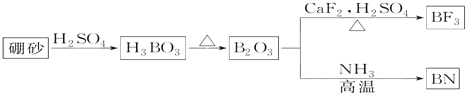
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式是___、___。
(2)基态B原子的电子排布式为___;B和N相比,非金属性较强的是___,BN中B元素的化合价为___;
(3)在BF3分子中,F﹣B﹣F的键角是___,该分子为___分子(填写“极性” 或“非极性”),BF3和过量NaF作用可生成NaBF4,BF4-中可能含有___,立体结构为___;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___,层间作用力为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应I: Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
反应Ⅱ:Al2O3(s)+3C(s) =2Al(g)+3CO(g) ΔH2=bkJ·mol-1
反应Ⅲ:3AlCl(g)=2Al(l)+AlCl3(g) ΔH3
①反应Ⅲ的△H3=____kJ/mol。
②950℃时,铝土矿(Al2O3)与足量的焦炭和C12反应可制得AlCl3。该反应的化学方程式是 _____________________________
(2)在高温条件下进行反应:2Al(l)+AlCl3 (g)![]() 3AlCl(g)
3AlCl(g)
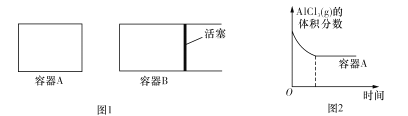
①向图1所示的起始容积相等的两个密闭容器A、B中加入足量的Al粉,再分别充入1molAICl3 (g),在相同的高温下进行反应。图2表示A容器内的AlC13(g)体积分数随时间的变化图,在图2中画出 B容器内AlCl3 (g)体积分数随时间的变化曲线____________。
②1 100℃时,向2L密闭容器中通入3mol AlCl(g),发生反应:3AlCl(g)![]() 2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
③加入3 mol AlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。则此反应选择温度为 _____________________
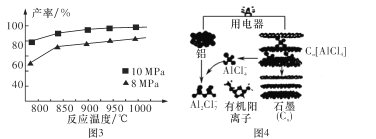
(3)铝可以用来制作快速放电铝离子二次电池,该电池以金属铝和石墨为电极,用AlCl4-、Al2Cl2-和有机阳离子组成电解质溶液,其工作原理如图4所示。
①该电池放电时,AlCl4-向 ___(填“铝电极”或“石墨电极”)方向移动。
②该电池充电时,阴极的电极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com