
不能用于判断金属失电子能力强弱的是
A.同主族金属元素原子半径大小
B.1 mol金属单质在反应中失去电子的多少
C.水溶液中金属间发生的置换反应
D.金属元素最高价氧化物对应水化物的碱性强弱
B
【解析】
试题分析:A、同主族金属元素原子,从上到下,原子半径逐渐增大,失电子能力越强,所以同主族金属元素原子半径大小能用于判断金属失电子能力强弱,故A正确;B、1mol金属单质失电子的多少由原子结构决定,与失电子能力强弱无关,所以1mol金属单质在反应中失去电子的多少不能用于判断金属失电子能力强弱,故B错误;C、活泼金属能将不活泼金属从其盐中置换出来,通过金属间发生的置换反应能用于判断金属失电子能力强弱,故C正确;D、金属元素的最高价氧化物对应的水化物的碱性越强,则失电子能力越强,可以通过金属元素的最高价氧化物对应的水化物的碱性强弱判断金属失电子能力强弱,故D正确。
考点:本题考查元素性质和元素周期表的递变规律。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
下列条件下,两瓶气体所含原子数、分子数一定相等的是
A.同温度、同体积的N2和CO B.同密度、同体积的H2和N2
C.同温度、同压强的C2H4和C3H6 D.同质量、不同密度的N2O和CO2
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
已知:N2(g)+3H2(g) 2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
| H2(g) | N2(g) | NH3(g) |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,
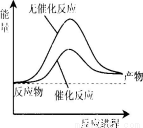
下列说法正确的是
A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期考试化学试卷(解析版) 题型:选择题
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下气体0.224 L.则下列判断中正确的是
A.原混合物中n(Fe)∶n(Fe2O3)=2∶1
B.向溶液中滴入KSCN溶液,显红色
C.无法计算原混合物的质量a
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期考试化学试卷(解析版) 题型:选择题
下列分子或离子在指定条件的分散系中能大量共存的是
A.Ca(NO3) 2溶液中: Fe2+、H+、Cl—、SO42—;
B.使pH试纸变蓝的溶液中:K+、NH4+、S-、SO32-;
C.水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、HCO3—、CH3COO-[;
D.透明的强酸性溶液中: Al3+、Fe3+、Cl-、SO42
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:填空题
(16分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
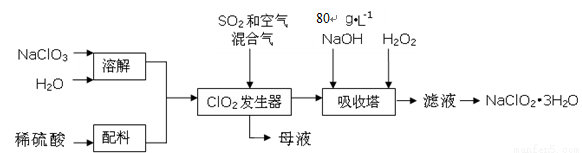
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③80 g·L-1 NaOH溶液是指80 g NaOH固体溶于水所得溶液的体积为1L。
(1)80 g·L-1 NaOH溶液的物质的量浓度为 ;
(2)发生器中鼓入空气的作用可能是 (选填序号);
a.将SO2氧化成SO3,增强酸性 b.将NaClO3氧化成ClO2 c.稀释ClO2以防止爆炸
(3)从“母液”中可回收的主要物质是 ;
(4)吸收塔内的反应的化学方程式为 ;
吸收塔的温度不能超过20℃,其目的是 ;
(5)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 ;
(6)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号);
a.Na2S b.Na2O2 c.FeCl2
(7) 从吸收塔出来的溶液中得到NaClO2?3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸发浓缩 b.蒸馏 c.过滤 d.灼烧 e.冷却结晶
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验操作中,错误的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.用100 mL容量瓶配制90mL1mol/L的NaOH溶液
C.用pH试纸测得新制氯水的pH为2
D.用酸式滴定管准确量取10.00mLKMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:选择题
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO 3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。
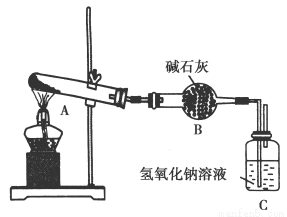
装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.4CuSO4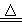 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A.2SO2(g)+O2(g)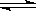 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)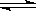 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+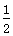 O2(g)
O2(g)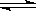 SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+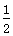 O2(g)
O2(g) SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com