
| A�� | ��H=-2 878 kJ•mol-1 | B�� | ��H=-2 658 kJ•mol-1 | ||
| C�� | ��H=-1 746 kJ•mol-1 | D�� | ��H=-1 526 kJ•mol-1 |
���� ȼ����ָ1mol��ȼ����ȫȼ�������ȶ��Ļ�����ʱ���ų�����������Ӧ����C��CO2��������H��H2O��Һ����S��SO2�������ȣ�
��� �⣺�������ȼ������1mol��������ȫȼ������CO2��������H2O��Һ���ų������������Ȼ�ѧ����ʽ��1��C4H10 ��g��+O2��g���T4CO2��g��+5H2O��l����H=-2878kJ/mol������ȼ���ȵĸ�������������ȼ����Ϊ-2878 kJ/mol��
��ѡ��A��
���� ���⿼��ѧ����ȼ�������⡢���Ȼ�ѧ����ʽ�����⣬�ѶȲ���ע���Ȼ�ѧ����ʽ�л�ѧ��������ʾ���ʵ���������ʾ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg2+��K+��NO3-��OH- | B�� | Ba2+��NH4+��NO3-��OH- | ||
| C�� | Ca2+��K+��SO42-��Cl- | D�� | Ba2+��Na+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֱ��������Һ�еμ�ϡH2S04������������ݣ�֤��ԭ��Һ��C032- | |
| B�� | ȡ������Һ����Ba��NO3��2��Һ�������ɫ������֤��ԭ��Һ�к�SO42- | |
| C�� | ȡ������Һ����HCl�ữ��μ�AgN03��Һ������ɫ������֤��ԭ��Һ�к�Cl-�� | |
| D�� | ȡ������Һ����HCl�ữ��μ�BaCL2��Һ������ɫ������֤��ԭ��Һ�к�SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
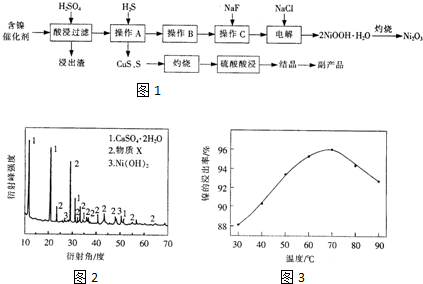
| �������� | Fe��OH��3 | Fe��OH��2 | Ni��OH��2 |
| ��ʼ������pH | 1.5 | 6.5 | 7.7 |
| ������ȫ��pH | 3.7 | 9.7 | 9.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
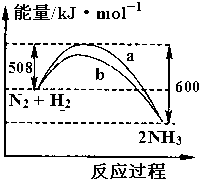
| A�� | �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2?2NH3��H=-92 kJ•mol-1 | |
| B�� | ��һ�ܱ������м���1 molN2��3 molH2��ַ�Ӧ�ų�92 kJ���� | |
| C�� | b���߿����Ǽ������ʱ�������仯���� | |
| D�� | ��N2+3H2?2NH3�У���Ӧ��ļ���֮�ʹ���������ļ���֮�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu��NO3��2 | B�� | Fe��NO3��3 | C�� | Fe��NO3��2 | D�� | Fe��NO3��2��Cu��NO3��2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com