
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO,K=4.5×10-4,次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO,K=4.5×10-4,次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
| ||
| ||
 HCl+HClO平衡会逆向移动,有效降低Cl2在饱和食盐水中的溶解度.
HCl+HClO平衡会逆向移动,有效降低Cl2在饱和食盐水中的溶解度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、钠的还原性很强,在空气中易变质,最后变为过氧化钠 |
| B、钠在工业上用于制氯化钠、氢氧化钠、碳酸钠等化合物 |
| C、钠与水反应时,会发生剧烈爆炸 |
| D、钠与硫酸铜溶液反应会置换出红色的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、SiO2、CO均为酸性氧化物 |
| B、稀豆浆、雾、氯化钠溶液均可形成胶体 |
| C、烧碱、冰醋酸、四氯化碳均为电解质 |
| D、盐酸、溴水、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Mg2+、NO3-、SO42- |
| B、Na+、HCO3-、SO42-、Cl- |
| C、Mg2+、Cl-、Ca2+、NO3- |
| D、Ba2+、NO3-、Ca2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用药匙取用粉末状或小颗粒状固体 | ||
| B、称量固体NaOH的质量时,分别在两个托盘上垫上质量相同的滤纸 | ||
C、给盛有约
| ||
| D、加热蒸发皿时无需垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:
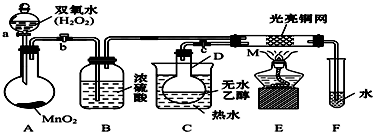
查看答案和解析>>
科目:高中化学 来源: 题型:
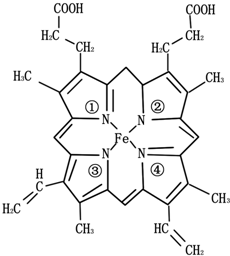 金属及其化合物在生产、生活中有广泛应用.
金属及其化合物在生产、生活中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:
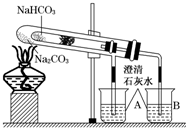 “套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:
“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com