
| A、①④ | B、①③ | C、②④ | D、③④ |
| △c |
| △t |
| 0.6 | ||
|
| 1.4 |
| 2 |
| 1.2 |
| 4 |
| 1.2mol | ||
|
| 0.6 | ||
|
| 1.4 |
| 2 |
| 1.2 |
| 4 |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
| A、CH4的摩尔质量是16g |
| B、物质的量是表示含有一定数目粒子集合体的物理量 |
| C、从100mL0.1mol/L盐酸中取出10mL,溶液密度不变 |
| D、4.4gCO2含有0.1mol粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
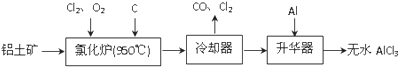
查看答案和解析>>
科目:高中化学 来源: 题型:
 分子筛具有均匀的微孔结构,分子筛筛分作用见图.
分子筛具有均匀的微孔结构,分子筛筛分作用见图.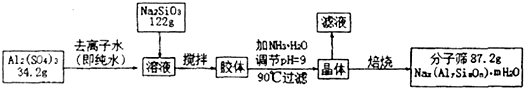
| ? |
| A |
| ? |
| A |
| ? |
| A |
| ? |
| A |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
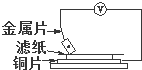 将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:| 金属 | 电流方向 | 电压/V |
| A | Cu→A | +0.78 |
| B | B→Cu | -0.30 |
| C | Cu→C | +1.35 |
| D | Cu→D | +0.15 |
| A、金属性由强到弱的顺序为:C>A>B>D |
| B、金属B不能从CuSO4溶液中置换出单质铜 |
| C、放金属C时铜片上发生的反应为:Cu-2e-=Cu2+ |
| D、金属D表面反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
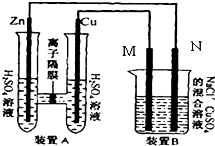 如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加
如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C5H12O3 |
| B、C4H10 |
| C、C6H10O4 |
| D、C5H10O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| B、用燃着的酒精灯去点燃另一盏酒精灯 |
| C、用天平称取药品时用手直接拿砝码 |
| D、用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com