
| A. | 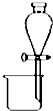 分离碘酒中的碘和酒精 | B. | 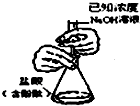 滴定法测定盐酸的浓度 | ||
| C. | 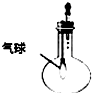 验证NH3的溶解性 | D. | 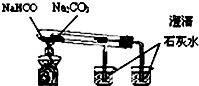 比较Na2CO2、NaHCO2的热稳定性 |
分析 A.碘和酒精不分层;
B.NaOH应利用碱式滴定管;
C.根据氨气极易溶于水对压强的影响分析;
D.碳酸氢钠应置于内置小试管中.
解答 解:A.碘和酒精不分层,不能选分液装置,故A错误;
B.NaOH应利用碱式滴定管,图中为酸式滴定管,故B错误;
C.氨气极易溶于水,烧瓶内压强减小,气球体积膨胀,可验证氨水的水溶性,故C正确;
D.碳酸氢钠易分解,为验证其稳定性,应置于内置小试管中,故D错误.
故选C.
点评 本题考查化学实验方案评价,涉及中和滴定、物质稳定性判断、物质分离和提纯、物质溶解性判断等知识点,为高频考点,侧重实验操作及实验原理考查,注意实验的评价性、操作性分析,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
 按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )
按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O 含有的分子数为 1 NA | |
| B. | 常温常压下,1.06 g Na2CO3 含有的 Na+离子数为 0.02 NA | |
| C. | 通常状况下,1 NA 个 CO2分子占有的体积为 22.4 L | |
| D. | 物质的量浓度为 0.5 mol/L 的 MgCl2溶液中,含有 Cl-个数为 1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Z>W | |
| C. | 单质的沸点:Z>W>X | |
| D. | X分别与Y、Z、W形成的化合物的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .如果要合成化合物A,其结构为:
.如果要合成化合物A,其结构为: ,下列说法正确的是( )
,下列说法正确的是( )| A. | 合成A的原料可能是:2-丁炔和2-甲基-1,3-丁二烯 | |
| B. | 合成A的原料可能是:丙炔和2,3-二甲基-1,3-丁二烯 | |
| C. | 该反应的原理是取代反应 | |
| D. | 化合物A和HBr 按照物质的量1:1加成时,有三种不同的产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com