
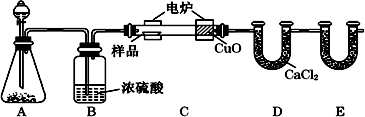
分析 用燃烧法测定有机物组成,A可用过氧化氢在二氧化锰催化作用下生成氧气(也可用过氧化钠和水),经B干燥后在C中与样品反应生成二氧化碳和水,C中CuO可将CO转化为二氧化碳,避免实验误差,D用于吸收水,E用于吸收二氧化碳,根据二氧化碳的质量可求C元素的质量,由水的质量可求得H元素的质量,结合有机物的质量可求出O元素的质量,由此即可确定有机物分子中C、H、O个数比,也就是确定了实验式,结合该有机物的相对分子质量可以确定有机物的分子式,以此解答该题.
解答 解:用燃烧法测定有机物组成,A可用过氧化氢在二氧化锰催化作用下生成氧气,经B干燥后在C中与样品反应生成二氧化碳和水,C中CuO可将CO转化为二氧化碳,避免实验误差,D用于吸收水,E用于吸收二氧化碳,根据二氧化碳的质量可求C元素的质量,由水的质量可求得H元素的质量,结合有机物的质量可求出O元素的质量,由此即可确定有机物分子中C、H、O个数比,也就是确定了实验式,结合该有机物的相对分子质量可以确定有机物的分子式,
(1)装置A是制备氧气的,所以根据装置的特点可知A装置中分液漏斗盛放的物质是双氧水或水,应该反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑,故答案为:H2O2或(H2O);2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑;
(2)由于有机物在燃烧过程中,有可能产生CO,所以C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O,
故答案为:CO转化为CO2,使实验数据更准确;
(3)装内有空气,空气中的二氧化碳会导致实验误差,为排尽装置中的空气,应先通入氧气,故答案为:排尽装置中的空气;
(4)由于有机物燃烧产生CO2,所以E装置的主要作用是吸收生成的CO2,因此其中所盛放试剂是碱石灰或氢氧化钠,
故答案为:碱石灰(或固体NaOH); 吸收燃烧生成的CO2;
(5)B装置的作用是干燥氧气,除去水蒸气,所以若将B装置去掉会造成测得有机物中含氢量增大,实验中,要避免空气中的水以及二氧化碳干扰试验,应该在E装置后接一个充满碱石灰的U形干燥管,
故答案为:将使测量数据中的氢元素含量增大;防止空气中的CO2和水蒸汽进入E装置,影响实验的准确性;
(6)E管质量增加1.76克说明生成了1.76克二氧化碳,可得碳元素的质量:1.76g×$\frac{12}{44}$×100%=0.48g,
D管质量增加0.72克说明生成了0.72克水,可得氢元素的质量:0.72g×$\frac{2}{18}$×100%=0.08g,
从而可推出含氧元素的质量为:1.2-0.48-0.08=0.64g,
设最简式为CXHYOZ,
12X:Y:16Z=0.48::0.08:0.64
X:Y:Z=1:2:1,
最简式为 CH2O,
可用质谱测定有机物的相对分子质量,该物质的相对分子质量为90,则分子式为C3H6O3,且该化合物能发生自身酯化反应,说明有机物含有羟基、羧基,结构简式应为CH3CHOHCOOH、CH2OHCH2COOH,
故答案为:CH2O; 质谱; CH3CHOHCOOH、CH2OHCH2COOH.
点评 本题考查有机物组成的测定,试题综合性强,难易适中,贴近高考,主要是考查学生灵活运用基础知识解决实际问题的能力,有助于培养学生的逻辑推理能力和发散思维能力.要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.


科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 0.1mol•L-1NaCl溶液中Na+的数目为0.1NA | |
| C. | 11.2 LCO2所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(CO32-)=0.01mol•L-1,c(NH4+)<c(SO42-) | |
| B. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ | |
| D. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
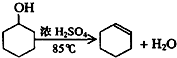
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
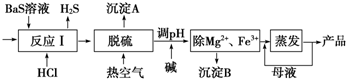
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com