
【题目】只有在化合物中才能存在的化学键是( )
A.离子键B.共价键C.极性键 D.非极性键
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法错误的是

A. 1mol甲分子内含有10mol共价键 B. 乙分子的一氯取代产物只有一种
C. 丙分子的二氯取代产物只有两种 D. 丁分子显然是不可能合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①白磷 ②金刚石 ③石墨 ④二氧化硅⑤甲烷 ⑥四氯化碳 ⑦铵根离子,其分子结构或晶体结构单元中存在正四面体的是( )
A. ①②④⑤⑥⑦ B. ①②⑤⑥ C. ②⑦ D. ③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是目前应用最多的金属,铁的单质及其化合物用途非常广泛。
(1)K4[Fe(CN)6]可用作食盐的抗结剂。基态钾原子的电子排布式为_______________。
(2)Na2[Fe(CN)5(NO)] 可用作治疗高血压急症。
①Na、N、O的第一电离能有小到大的顺序为_______________。
②CN-中碳原子的杂化类型是_______________。
(3)过氧化氢在FeCl3催化作用下分解生成水和氧气。
①1molH2O2中σ键的数目为_______________。
②H2O的沸点比H2S高的原因是_______________。
(4)铁触媒是重要的催化剂。CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
①与CO互为等电子体的分子为_____________。配合物[Cu(NH3)2]OOCCH3中不存在的的作用力是_______(填字母)。
a.离子键 b.金属键 c.配位键 d.极性共价键
②Fe(CO)5在空气中燃烧的化学方程式为4Fe(CO)5+13O2 ![]() 2Fe2O3+20CO2,Fe2O3的晶体类型是___________。
2Fe2O3+20CO2,Fe2O3的晶体类型是___________。
③铁的晶胞如图所示,若该晶体的密度是ag·cm-3,则两个最近的Fe原子间的距离为_____cm(设NA为阿伏伽德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
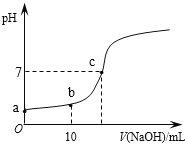
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,研究pH对一定浓度FeSO4的稳定性的影响,根据下图分析不合理的是

A. pH小于1时,亚铁几乎无损耗,可能的原因是4Fe2++ O2+ 10H2O![]() 4Fe(OH)3 + 8H+平衡逆向移动
4Fe(OH)3 + 8H+平衡逆向移动
B. pH在3.0~5.5之间,pH的变化对FeSO4稳定性影响不大
C. pH大于6.5时,亚铁损耗量突变,可能的原因是生成的Fe(OH) 2更易被氧化
D. 其它条件相同时,FeSO4溶液中加入少量(NH4)2SO4固体,FeSO4的稳定性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究Na2S溶液与KMnO4溶液反应,探究过程如下。
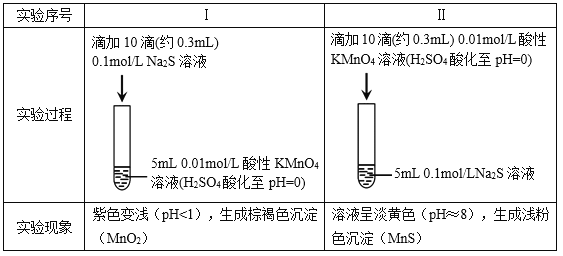
资料:ⅰ. ![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ. 单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有________性。
(2)甲同学预测实验I中S2–被氧化成![]() 。
。
①根据实验现象,乙同学认为甲的预测不合理,理由是________。
②乙同学取实验I中少量溶液进行实验,检测到有![]() ,得出S2–被氧化成
,得出S2–被氧化成![]() 的结论,丙同学否定了该结论,理由是________。
的结论,丙同学否定了该结论,理由是________。
③同学们经讨论后,设计了如下实验,证实该条件下![]() 的确可以将S2–氧化成
的确可以将S2–氧化成![]() 。
。
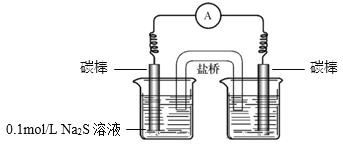
a.右侧烧杯中的溶液是________。
b.连通后电流计指针偏转,一段时间后,________(填操作和现象)。
(3)实验I的现象与资料i存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(![]() )发生反应,该反应的离子方程式是________。
)发生反应,该反应的离子方程式是________。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是______。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与________因素有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B. 25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小
C. pH试纸测得新制氯水的pH为4.5
D. FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com