
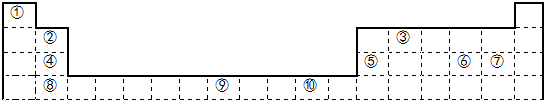
分析 由元素在周期表中的位置可知,①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Fe,⑩为Cu,
(1)d区元素在副族元素和过渡元素区;
(2)元素①的6个原子与元素③的6个原子形成的某种环状分子为苯,③和⑦形成的常见化合物为CCl4;
(3)金属的第一电离能小于非金属,一般非金属性越强,第一电离能越小;镁的3s全满,则其第一电离能大于铝;
(4)③为C,⑥为S,二者形成的化合物为二硫化碳,二氧化硫结构与二氧化碳相似,分子中含有两个碳硫双键,据此判断含有的化学键数目;
(5)元素的特征电子排布式为nsnnpn+1,n只能为2,则该元素为N,形成的分子X为NH3,氨气为极性键形成的极性分子;
(6)元素②的氢氧化物与NaOH溶液反应反应生成Na2BeO2;
(7)计算晶胞中原子个数,晶体中晶胞重复出现,推算到晶体中的原子个数.
解答 解:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Fe,⑩为Cu,
(1)d区元素在副族元素和过渡元素区,Cu位于ds区,只有Fe位于d区,
故答案为:⑨;
(2)元素①的6个原子与元素③的6个原子形成的某种环状分子为苯,③和⑦形成的常见化合物为CCl4,
故答案为:苯;
(3)一般非金属性越强,第一电离能越大,则金属的第一电离能小于非金属的,由于Mg的3s全满,其第一电离能比铝的大,所以第一电离能大小为:Cl>S>Mg>Al,
故答案为:Cl>S>Mg>Al;
(4)按原子轨道的重叠方式,③与⑥形成的化合物二氧化硫中含有两个双键,则其分子中含有2个σ键、2个π键,
故答案为:2;2;
(5)元素的特征电子排布式为nsnnpn+1,n只能为2,则该元素为N,最外层有5个电子,孤对电子数为1,形成的分子X为NH3,空间构成为三角锥形,氨气是由极性键形成的极性分子,
故答案为:1;三角锥形;极性;
(6)元素②的氢氧化物与NaOH溶液反应反应生成Na2BeO2,该反应为Be(OH)2+2NaOH═Na2BeO2+2H2O,
故答案为:Be(OH)2+2NaOH═Na2BeO2+2H2O;
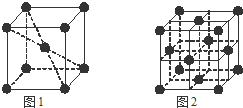
(7)在1183K以下,为左图所示,可知体心中有一个原子周围有八个原子,故每个晶胞中有8个原子与中心原子等距离且最近,在晶体中依然为8个,在1183K以上时为右图所示,以最上面中间原子为为例,同一个平面上有4个原子距离相等且距离最小,在竖直方向的四个面上,中间原子与所选定原子等距离且距离最小,在晶体中晶胞重复出现,故对面会有对称的四个竖直面上的点,一共12个,
故答案为:8;12.
点评 本题考查位置、结构、性质的应用,涉及元素周期表中元素的分区、元素周期表中元素的位置、化学键类型、分子构型、化学反应等,综合性较强,题目难度较大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②
② ③
③ ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦ ⑧
⑧
| A. | ①和 ② | B. | ④和⑥ | C. | ⑤和⑦; ④和⑧ | D. | ①和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为金属元素 | D. | 丁一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 图示 |  | 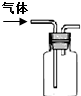 | 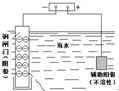 | 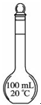 |
| 说明 | 主要成分是蔗糖作调味剂 | 该装置可以收集二氧化氮 | 该装置可保护钢阀门不被腐蚀 | 该仪器用于配制一定质量分数的溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )
,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )| A. | 4种 | B. | 9种 | C. | 12种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com