
| 实验操作 | 实验目的 | |
| A | 将SO2通入紫色石蕊溶液中 | 证明SO2具有漂白性 |
| B | 取两支试管,分别加入4mlL0.01mol•L-1KMnO4溶液,然后向另一支试管中加入0.1mol•L-1H2C2O4溶液2mL,向另一支试管中加入0.1mol•L-1H2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| C | 向10mL0.2mol•L-1NaOH溶液中滴入2滴0.1mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的溶度积: Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向含酚酞的Na2SO3溶液中加入BaCl2溶液 | 证明Na2SO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO2通入紫色石蕊溶液中,溶液变红;
B.浓度不同,且生成锰离子可作催化剂;
C.NaOH足量,均为沉淀的生成;
D.Na2SO3与BaCl2反应生成沉淀,水解平衡逆向移动,碱性减弱.
解答 解:A.SO2通入紫色石蕊溶液中,溶液变红,体现酸性氧化物的性质,与漂白性无关,故A错误;
B.浓度不同,且生成锰离子可作催化剂,应控制溶液的总体积相同,结论不合理,故B错误;
C.NaOH足量,均为沉淀的生成,不发生沉淀的转化,则不能比较Ksp,故C错误;
D.Na2SO3与BaCl2反应生成沉淀,水解平衡逆向移动,碱性减弱,溶液由红色变为无色,则证明Na2SO3溶液中存在水解平衡,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应速率的影响因素、沉淀生成、水解平衡为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
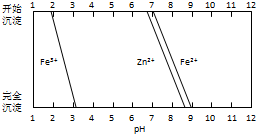 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
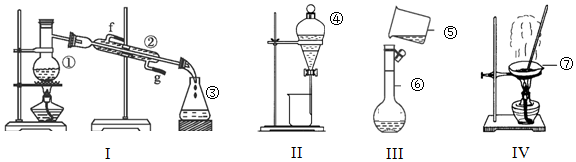
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
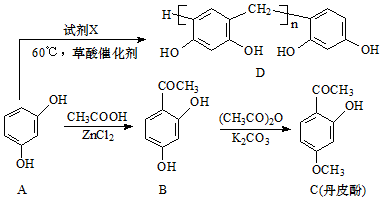
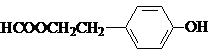 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③<②<① | |
| B. | 工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2,随着SO2的吸收,吸收液的pH不断变化.当吸收液呈酸性时:c (Na+)=c (SO32-)+c (HSO3-)+c (H2SO3) | |
| C. | 常温下,将0.1 mol•L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍 | |
| D. | 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH 和 CH3COOH 互为同系物 | |
| B. | 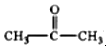 与CH3CH2CHO互为同分异构体 与CH3CH2CHO互为同分异构体 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| D. | 烷烃CH3CH(CH3)C(CH3)3的名称是2,3,3-三甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{35}$Cl与 ${\;}_{17}^{37}$Cl得电子能力不相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com