
| A. | 绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的物质 | |
| B. | 回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开友废电池的综合利用技术 | |
| D. | 生铁炼钢时必须完全除去生铁中的碳,以避免因钢铁中含有碳而发生电化学腐蚀 |
分析 A.依据焰色反应解答;
B.废塑料通常采用热解油化技术加以回收,即通过加热或加入一定的催化剂使废塑料分解,获得新的燃料汽油、燃料油气等;
C.电池中含有铅、镉等重金属,容易造成环境污染;
D.生铁炼钢的过程中,含碳量在减少,但不能完全除去.
解答 解:A.烟花中添加含钾、钠、钙、铜等某些金属元素的化合物,燃放时发生焰色反应而呈现绚丽缤纷的颜色,故A正确;
B.回收废弃塑料制成燃油替代汽、柴油,可减轻环境污染和节约化石能源,故B正确;
C.电池中含有铅、镉等重金属,容易造成环境污染,应积极开友废电池的综合利用技术,故C正确;
D.生铁炼钢的过程中,含碳量在减少,但不能完全除去,所以不可避免因钢铁中含有碳而发生电化学腐蚀,故D错误;
故选:D.
点评 本题考查了化学与生产生活,熟悉焰色反应原理、明确生活中常见环境污染与治理方法、熟悉炼铁原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}S$ | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | H2O2的电子式: | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释到原体积的10倍,溶液的pH=4 | |
| B. | 加水稀释,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变,n(OH-)增大 | |
| C. | 加入10 mL pH=11的NaOH溶液,所得混合液的pH=7 | |
| D. | 加入少量醋酸钠固体,则平衡CH3COOH?CH3COO-+H+逆向移动,K变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C(s)+H2O(g)=CO(g)+H2(g)△H>0 | B. | NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0 | ||
| C. | 2CO(g)+O2(g)=2CO2(1)△H<0 | D. | 2H2(g)+O2(g)═2H2O(l)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应一定是氧化还原反应 | |
| B. | 有单质参加的反应一定是氧化还原反应 | |
| C. | 分解反应可能是氧化还原反应 | |
| D. | 凡是氧化还原反应都不可能是复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
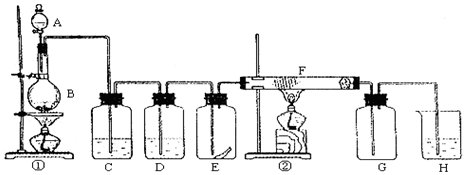
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com