
| ||
| ”÷ |
| 11.2L |
| 22.4L/mol |
| 4.48L |
| 22.4L/mol |
| 0.1mol |
| 0.2mol |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012½ģ½ĖÕŹ”»“°²ŹŠ·¶¼Æ֊ѧøßČżµŚŅ»“ĪČ«ÕęÄ£Äā²āŹŌ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
£Ø12·Ö£©¹żŃõ»ÆĒāŗĶ³ōŃõ¶¼ŹĒ³£¼ūµÄĀĢÉ«Ńõ»Æ¼Į£¬ŌŚ¹¤ŅµÉś²śÖŠÓŠ×ÅÖŲŅŖµÄÓĆĶ¾”£
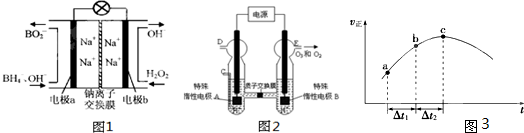
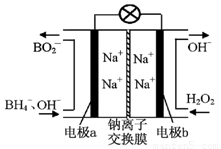
£Ø1£©¾Ż±ØµĄŅŌÅšĒā»ÆŗĻĪļNaBH4£ØBµÄ»ÆŗĻ¼ŪĪŖ+3¼Ū£©ŗĶH2O2×÷ŌĮĻµÄČ¼ĮĻµē³Ų£¬æÉÓĆ×÷ĶØŠÅĪĄŠĒµēŌ“”£øŗ¼«²ÄĮĻ²ÉÓĆPt/C£¬Õż¼«²ÄĮĻ²ÉÓĆMnO2£¬Ę乤×÷ŌĄķČēĶ¼7ĖłŹ¾”£øƵē³Ų·ÅµēŹ±Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ £»ŅŌMnO2×öÕż¼«²ÄĮĻ£¬æÉÄÜŹĒŅņĪŖ ”£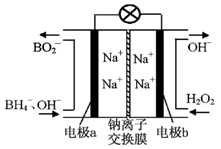
£Ø2£©»š¼ż·¢Éä³£ŅŌŅŗĢ¬ėĀ£ØN2H4£©ĪŖČ¼ĮĻ£¬ŅŗĢ¬¹żŃõ»ÆĒāĪŖÖśČ¼¼Į”£
ŅŃÖŖ£ŗN2H4(g) + O2(g) £½ N2(g) + 2H2O(g) ”÷H =" ØC" 534 kJ”¤mol”Ŗ1
H2O2(l) = H2O(l) + 1/2O2(g) ”÷H =" ØC" 98.64 kJ”¤mol”Ŗ1
H2O(l) = H2O(g) ”÷H=" +" 44kJ”¤mol”Ŗ1
·“Ó¦N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) µÄ”÷H= ”£
£Ø3£©O3 æÉÓɳōŃõ·¢ÉśĘ÷£ØŌĄķČēĶ¼ĖłŹ¾£©µē½āĻ”ĮņĖįÖʵƔ£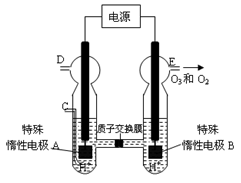
¢ŁĶ¼ÖŠŅõ¼«ĪŖ £ØĢī”°A”±»ņ”°B”±£©”£
¢ŚČōC“¦ĶØČėO 2£¬ŌņA¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ ”£
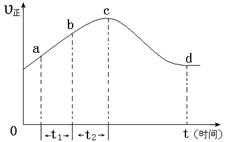
¢ŪČōC“¦²»ĶØČėO 2 £¬D”¢E“¦·Ö±šŹÕ¼Æµ½11.2LŗĶÓŠ4.48LĘųĢå£Ø±ź×¼×“æöĻĀ£©£¬ŌņE“¦ŹÕ¼ÆµÄĘųĢåÖŠO3ĖłÕ¼µÄĢå»ż·ÖŹżĪŖ £ØŗöĀŌ O 3 µÄ·Ö½ā£©”£ £Ø4£©ŠĀŠĶO3Ńõ»Æ¼¼Źõ¶ŌČ¼ĆŗŃĢĘųÖŠµÄNOxŗĶSO2ĶŃ³żŠ§¹ūĻŌÖų£¬¹ųĀÆŃĢĘųÖŠµÄNOx 95£„ŅŌÉĻŹĒŅŌNOŠĪŹ½“ęŌŚµÄ£¬æÉ·¢Éś·“Ó¦NO(g£©+ O3 (g) NO2(g)+ O2 (g)”£ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«NOŗĶO3ĶØČė¾ųČČŗćČŻĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬Õż·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄŹ¾ŅāĶ¼£ØČēĶ¼9£©ĖłŹ¾”£ÓÉĶ¼æÉµĆ³öµÄÕżČ·Ėµ·ØŹĒ
£Ø4£©ŠĀŠĶO3Ńõ»Æ¼¼Źõ¶ŌČ¼ĆŗŃĢĘųÖŠµÄNOxŗĶSO2ĶŃ³żŠ§¹ūĻŌÖų£¬¹ųĀÆŃĢĘųÖŠµÄNOx 95£„ŅŌÉĻŹĒŅŌNOŠĪŹ½“ęŌŚµÄ£¬æÉ·¢Éś·“Ó¦NO(g£©+ O3 (g) NO2(g)+ O2 (g)”£ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«NOŗĶO3ĶØČė¾ųČČŗćČŻĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬Õż·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄŹ¾ŅāĶ¼£ØČēĶ¼9£©ĖłŹ¾”£ÓÉĶ¼æÉµĆ³öµÄÕżČ·Ėµ·ØŹĒ 
a£®·“Ó¦ŌŚcµć“ļµ½Ę½ŗāדĢ¬
b£®·“Ó¦ĪļÅØ¶Č£ŗbµćŠ”ÓŚcµć
c£®·“Ó¦ĪļµÄ×ÜÄÜĮæµĶÓŚÉś³ÉĪļµÄ×ÜÄÜĮæ
d£®¦¤t1£½¦¤t2Ź±£¬NOµÄ×Ŗ»ÆĀŹ£ŗa”«b¶ĪŠ”ÓŚb”«c¶Ī
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģ½ĖÕŹ”ŃĪ³ĒŹŠĆ÷“ļ֊ѧøßČżÉĻѧʌѧĒéµ÷ŃŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
(14 ·Ö)¹żŃõ»ÆĒāŗĶ³ōŃõ¶¼ŹĒ³£¼ūµÄĀĢÉ«Ńõ»Æ¼Į£¬ŌŚ¹¤ŅµÉś²śÖŠÓŠ×ÅÖŲŅŖµÄÓĆĶ¾”£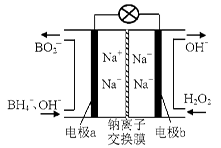
£Ø1£©¾Ż±ØµĄŅŌÅšĒā»ÆŗĻĪļNaBH4£ØBµÄ»ÆŗĻ¼ŪĪŖ+3¼Ū£©ŗĶH2O2×÷ŌĮĻµÄČ¼ĮĻµē³Ų£¬æÉÓĆ×÷ĶØŠÅĪĄŠĒµēŌ“”£øŗ¼«²ÄĮĻ²ÉÓĆPt/C£¬Õż¼«²ÄĮĻ²ÉÓĆMnO2£¬Ę乤×÷ŌĄķČēÓŅĶ¼ĖłŹ¾”£øƵē³Ų·ÅµēŹ±Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ £»
ŅŌMnO2×öÕż¼«²ÄĮĻ£¬æÉÄÜŹĒŅņĪŖ ”£
£Ø2£©»š¼ż·¢Éä³£ŅŌŅŗĢ¬ėĀ£ØN2H4£©ĪŖČ¼ĮĻ£¬ŅŗĢ¬¹żŃõ»ÆĒā
ĪŖÖśČ¼¼Į”£ŅŃÖŖ£ŗ
N2H4(g) + O2(g) £½ N2(g) + 2H2O(g) ”÷H =" ØC" 534 kJ”¤mol-1
H2O2(l) = H2O(l) + 1/2O2(g) ”÷H =" ØC" 98.64 kJ”¤mol-1
H2O(l) = H2O(g) ”÷H=" +" 44kJ”¤mol-1
Ōņ·“Ó¦N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) µÄ”÷H= ”£
£Ø3£©O3 æÉÓɳōŃõ·¢ÉśĘ÷£ØŌĄķČēÓŅĶ¼ĖłŹ¾£©µē½āĻ”ĮņĖįÖʵƔ£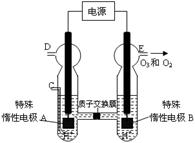
¢Ś Ķ¼ÖŠŅõ¼«ĪŖ £ØĢī”°A”±»ņ”°B”±£©”£
¢ŚČōC“¦ĶØČėO 2£¬ŌņA¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ ”£
¢ŪČōC“¦²»ĶØČėO 2 £¬D”¢E“¦·Ö±šŹÕ¼Æµ½15.68LŗĶÓŠ6.72LĘųĢå£Ø±ź×¼×“æöĻĀ£©£¬ŌņE“¦ŹÕ¼ÆµÄĘųĢåÖŠO2ŗĶO3µÄĢå»żÖ®±ČĪŖ £ØŗöĀŌ O 3 µÄ·Ö½ā£©”£
£Ø4£©ŠĀŠĶO3Ńõ»Æ¼¼Źõ¶ŌČ¼ĆŗŃĢĘųÖŠµÄNOxŗĶSO2ĶŃ³żŠ§¹ūĻŌÖų£¬¹ųĀÆŃĢĘųÖŠµÄNOx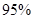 ŅŌÉĻŹĒŅŌNOŠĪŹ½“ęŌŚµÄ£¬æÉ·¢Éś·“Ó¦NO(g£©+ O3 (g)
ŅŌÉĻŹĒŅŌNOŠĪŹ½“ęŌŚµÄ£¬æÉ·¢Éś·“Ó¦NO(g£©+ O3 (g)  NO2(g)+ O2 (g)”£ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«NOŗĶO3ĶØČė¾ųČČŗćČŻĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦ £¬Õż·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄŹ¾ŅāĶ¼£ØČēĻĀĶ¼£©ĖłŹ¾”£ÓÉĶ¼æÉµĆ³öµÄÕżČ·Ėµ·ØŹĒ
NO2(g)+ O2 (g)”£ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«NOŗĶO3ĶØČė¾ųČČŗćČŻĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦ £¬Õż·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄŹ¾ŅāĶ¼£ØČēĻĀĶ¼£©ĖłŹ¾”£ÓÉĶ¼æÉµĆ³öµÄÕżČ·Ėµ·ØŹĒ 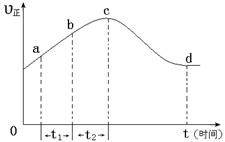
a£®·“Ó¦ŌŚcµć“ļµ½Ę½ŗāדĢ¬
b£®·“Ó¦ĪļÅØ¶Č£ŗbµćŠ”ÓŚcµć
c£®øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦
d£®¦¤t1£½¦¤t2Ź±£¬NOµÄ×Ŗ»ÆĮæ£ŗa”«b¶ĪŠ”ÓŚb”«c¶Ī
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğ½ĖÕŹ”ŃĪ³ĒŹŠøßČżÉĻѧʌѧĒéµ÷ŃŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(14 ·Ö)¹żŃõ»ÆĒāŗĶ³ōŃõ¶¼ŹĒ³£¼ūµÄĀĢÉ«Ńõ»Æ¼Į£¬ŌŚ¹¤ŅµÉś²śÖŠÓŠ×ÅÖŲŅŖµÄÓĆĶ¾”£
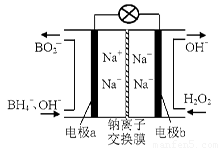
£Ø1£©¾Ż±ØµĄŅŌÅšĒā»ÆŗĻĪļNaBH4£ØBµÄ»ÆŗĻ¼ŪĪŖ+3¼Ū£©ŗĶH2O2×÷ŌĮĻµÄČ¼ĮĻµē³Ų£¬æÉÓĆ×÷ĶØŠÅĪĄŠĒµēŌ“”£øŗ¼«²ÄĮĻ²ÉÓĆPt/C£¬Õż¼«²ÄĮĻ²ÉÓĆMnO2£¬Ę乤×÷ŌĄķČēÓŅĶ¼ĖłŹ¾”£øƵē³Ų·ÅµēŹ±Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ £»
ŅŌMnO2×öÕż¼«²ÄĮĻ£¬æÉÄÜŹĒŅņĪŖ ”£
£Ø2£©»š¼ż·¢Éä³£ŅŌŅŗĢ¬ėĀ£ØN2H4£©ĪŖČ¼ĮĻ£¬ŅŗĢ¬¹żŃõ»ÆĒā
ĪŖÖśČ¼¼Į”£ŅŃÖŖ£ŗ
N2H4(g) + O2(g) £½ N2(g) + 2H2O(g) ”÷H =" ØC" 534 kJ”¤mol-1
H2O2(l) = H2O(l) + 1/2O2(g) ”÷H =" ØC" 98.64 kJ”¤mol-1
H2O(l) = H2O(g) ”÷H=" +" 44kJ”¤mol-1
Ōņ·“Ó¦N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) µÄ”÷H= ”£
£Ø3£©O3 æÉÓɳōŃõ·¢ÉśĘ÷£ØŌĄķČēÓŅĶ¼ĖłŹ¾£©µē½āĻ”ĮņĖįÖʵƔ£
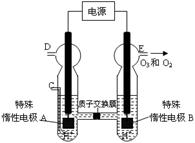
¢Ś Ķ¼ÖŠŅõ¼«ĪŖ £ØĢī”°A”±»ņ”°B”±£©”£
¢ŚČōC“¦ĶØČėO 2£¬ŌņA¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ ”£
¢ŪČōC“¦²»ĶØČėO 2 £¬D”¢E“¦·Ö±šŹÕ¼Æµ½15.68LŗĶÓŠ6.72LĘųĢå£Ø±ź×¼×“æöĻĀ£©£¬ŌņE“¦ŹÕ¼ÆµÄĘųĢåÖŠO2ŗĶO3µÄĢå»żÖ®±ČĪŖ £ØŗöĀŌ O 3 µÄ·Ö½ā£©”£
£Ø4£©ŠĀŠĶO3Ńõ»Æ¼¼Źõ¶ŌČ¼ĆŗŃĢĘųÖŠµÄNOxŗĶSO2ĶŃ³żŠ§¹ūĻŌÖų£¬¹ųĀÆŃĢĘųÖŠµÄNOx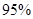 ŅŌÉĻŹĒŅŌNOŠĪŹ½“ęŌŚµÄ£¬æÉ·¢Éś·“Ó¦NO(g£©+ O3 (g)
ŅŌÉĻŹĒŅŌNOŠĪŹ½“ęŌŚµÄ£¬æÉ·¢Éś·“Ó¦NO(g£©+ O3 (g)  NO2(g)+ O2 (g)”£ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«NOŗĶO3ĶØČė¾ųČČŗćČŻĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦ £¬Õż·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄŹ¾ŅāĶ¼£ØČēĻĀĶ¼£©ĖłŹ¾”£ÓÉĶ¼æÉµĆ³öµÄÕżČ·Ėµ·ØŹĒ
NO2(g)+ O2 (g)”£ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«NOŗĶO3ĶØČė¾ųČČŗćČŻĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦ £¬Õż·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄŹ¾ŅāĶ¼£ØČēĻĀĶ¼£©ĖłŹ¾”£ÓÉĶ¼æÉµĆ³öµÄÕżČ·Ėµ·ØŹĒ
a£®·“Ó¦ŌŚcµć“ļµ½Ę½ŗāדĢ¬
b£®·“Ó¦ĪļÅØ¶Č£ŗbµćŠ”ÓŚcµć
c£®øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦
d£®¦¤t1£½¦¤t2Ź±£¬NOµÄ×Ŗ»ÆĮæ£ŗa”«b¶ĪŠ”ÓŚb”«c¶Ī
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğ½ĖÕŹ”»“°²ŹŠøßČżµŚŅ»“ĪČ«ÕęÄ£Äā²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø12·Ö£©¹żŃõ»ÆĒāŗĶ³ōŃõ¶¼ŹĒ³£¼ūµÄĀĢÉ«Ńõ»Æ¼Į£¬ŌŚ¹¤ŅµÉś²śÖŠÓŠ×ÅÖŲŅŖµÄÓĆĶ¾”£
£Ø1£©¾Ż±ØµĄŅŌÅšĒā»ÆŗĻĪļNaBH4£ØBµÄ»ÆŗĻ¼ŪĪŖ+3¼Ū£©ŗĶH2O2×÷ŌĮĻµÄČ¼ĮĻµē³Ų£¬æÉÓĆ×÷ĶØŠÅĪĄŠĒµēŌ“”£øŗ¼«²ÄĮĻ²ÉÓĆPt/C£¬Õż¼«²ÄĮĻ²ÉÓĆMnO2£¬Ę乤×÷ŌĄķČēĶ¼7ĖłŹ¾”£øƵē³Ų·ÅµēŹ±Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ £»ŅŌMnO2×öÕż¼«²ÄĮĻ£¬æÉÄÜŹĒŅņĪŖ ”£
£Ø2£©»š¼ż·¢Éä³£ŅŌŅŗĢ¬ėĀ£ØN2H4£©ĪŖČ¼ĮĻ£¬ŅŗĢ¬¹żŃõ»ÆĒāĪŖÖśČ¼¼Į”£
ŅŃÖŖ£ŗ N2H4(g) + O2(g) £½ N2(g) + 2H2O(g) ”÷H = ØC 534 kJ”¤mol”Ŗ1
H2O2(l) = H2O(l) + 1/2O2(g) ”÷H = ØC 98.64 kJ”¤mol”Ŗ1
H2O(l) = H2O(g) ”÷H= + 44kJ”¤mol”Ŗ1
·“Ó¦N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) µÄ ”÷H= ”£
£Ø3£©O3 æÉÓɳōŃõ·¢ÉśĘ÷£ØŌĄķČēĶ¼ĖłŹ¾£©µē½āĻ”ĮņĖįÖʵƔ£
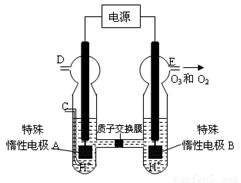
¢ŁĶ¼ÖŠŅõ¼«ĪŖ £ØĢī”°A”±»ņ”°B”±£©”£
¢ŚČōC“¦ĶØČėO 2£¬ŌņA¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ ”£
¢ŪČōC“¦²»ĶØČėO 2 £¬D”¢E“¦·Ö±šŹÕ¼Æµ½11.2LŗĶÓŠ4.48LĘųĢå£Ø±ź×¼×“æöĻĀ£©£¬ŌņE“¦ŹÕ¼ÆµÄĘųĢåÖŠO3ĖłÕ¼µÄĢå»ż·ÖŹżĪŖ £ØŗöĀŌ O 3 µÄ·Ö½ā£©”£
 £Ø4£©ŠĀŠĶO3Ńõ»Æ¼¼Źõ¶ŌČ¼ĆŗŃĢĘųÖŠµÄNOxŗĶSO2ĶŃ³żŠ§¹ūĻŌÖų£¬¹ųĀÆŃĢĘųÖŠµÄNOx 95£„ŅŌÉĻŹĒŅŌNOŠĪŹ½“ęŌŚµÄ£¬æÉ·¢Éś·“Ó¦NO(g£©+ O3
(g) NO2(g)+ O2 (g)”£ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«NOŗĶO3ĶØČė¾ųČČŗćČŻĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦ £¬Õż·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄŹ¾ŅāĶ¼£ØČēĶ¼9£©ĖłŹ¾”£ÓÉĶ¼æÉµĆ³öµÄÕżČ·Ėµ·ØŹĒ
£Ø4£©ŠĀŠĶO3Ńõ»Æ¼¼Źõ¶ŌČ¼ĆŗŃĢĘųÖŠµÄNOxŗĶSO2ĶŃ³żŠ§¹ūĻŌÖų£¬¹ųĀÆŃĢĘųÖŠµÄNOx 95£„ŅŌÉĻŹĒŅŌNOŠĪŹ½“ęŌŚµÄ£¬æÉ·¢Éś·“Ó¦NO(g£©+ O3
(g) NO2(g)+ O2 (g)”£ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«NOŗĶO3ĶØČė¾ųČČŗćČŻĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦ £¬Õż·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄŹ¾ŅāĶ¼£ØČēĶ¼9£©ĖłŹ¾”£ÓÉĶ¼æÉµĆ³öµÄÕżČ·Ėµ·ØŹĒ
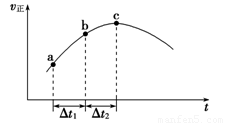
a£®·“Ó¦ŌŚcµć“ļµ½Ę½ŗāדĢ¬
b£®·“Ó¦ĪļÅØ¶Č£ŗbµćŠ”ÓŚcµć
c£®·“Ó¦ĪļµÄ×ÜÄÜĮæµĶÓŚÉś³ÉĪļµÄ×ÜÄÜĮæ
d£®¦¤t1£½¦¤t2Ź±£¬NOµÄ×Ŗ»ÆĀŹ£ŗa”«b¶ĪŠ”ÓŚb”«c¶Ī
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com