
在相同的温度下,已知如下反应,则Q1,Q2,Q3大小关系是
2H2(g)+O2(g)=2H2O(g);ΔH=-Q1
2H2(g)+O2(g)=2H2O(l);ΔH=-Q2
H2(g)+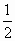 O2(g)=H2O(l);ΔH=-Q3
O2(g)=H2O(l);ΔH=-Q3
[ ]
科目:高中化学 来源:江西省白鹭洲中学2011-2012学年高二第一次月考化学试题 题型:013
|
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) | |
| [ ] | |
A. |
0.40 mol |
B. |
0.20 mol |
C. |
小于0.20 mol |
D. |
大于0.20 mol,小于0.40 mol |
查看答案和解析>>
科目:高中化学 来源:福建省泉州市2010年高中毕业班五月质量检测理综化学部分 题型:填空题
(15分)
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 。
| A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红 |
| B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红 |
| C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成 |
| D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成 |
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O  C6H12O6+6O2 b .CO2+3H2?
C6H12O6+6O2 b .CO2+3H2?  CH3OH+H2O
CH3OH+H2O
c.CO2+CH4  CH3COOH d. 2CO2+6H2
CH3COOH d. 2CO2+6H2  CH2==CH2+4H2O
CH2==CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
|
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) ![]() 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
|
图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解的催化效果,甲、乙同学分别设计了如图一、图二所示的实验。
(1) H2O2分解的化学方程式为 。
 |
图一 图二
(2)图一所示实验能定性说明反应快慢的依据是 _______________________________;
图二所示实验能说明反应快慢的数据是____________________________________。
(3)① 用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H= + 64.39 kJ/mol
2H2O2(l)=2H2O(l) + O2(g) △H= ﹣196. 46 kJ/mol
H2(g) + 1/2O2(g) = H2O(l) △H= ﹣285. 84 kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+ 和H2O的热化学方程式为:
。
② 控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3 .0 mol/L H2SO4的混
合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 (×10—3 mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因
是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com