
今有:①纯净的碳酸钠ag;②碳酸钠与碳酸氢钠的混合物ag.两者相比,下列各种情况的描述正确的是()
| A. | 分别和盐酸完全反应时,混合物的耗酸量多 | |
| B. | 分别和盐酸完全反应时,纯净的碳酸钠放出的CO2多 | |
| C. | 分别溶于水,再加入足量澄清石灰水,混合物得到的沉淀质量大 | |
| D. | 分别配成等体积的溶液,混合物溶液的Na+的物质的量浓度大 |
| 钠的重要化合物. | |
| 专题: | 元素及其化合物. |
| 分析: | 碳酸钠和碳酸氢钠分别与盐酸发生:CO32﹣+2H+=CO2↑+H2O,HCO3﹣+H+=CO2↑+H2O,可根据反应的离子方程式判断消耗的盐酸以及生成的二氧化碳的量的关系,碳酸钠与碳酸氢钠都可与澄清石灰水反应生成沉淀,以此解答该题. |
| 解答: | 解:碳酸钠和碳酸氢钠分别与盐酸发生:CO32﹣+2H+=CO2↑+H2O,HCO3﹣+H+=CO2↑+H2O,等质量时,碳酸钠消耗盐酸的物质的量为 A.分别和盐酸反应时,ag纯净的碳酸钠消耗盐酸的物质的量为 B.分别和足量盐酸反应时,ag纯净的碳酸钠生成二氧化碳的物质的量为 C.分别溶于水,再加入足量澄清石灰水,都可生成碳酸钙沉淀,ag纯净的碳酸钠生成碳酸钙的物质的量为 D.碳酸钠含有Na+的物质的量为 故选C. |
| 点评: | 本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意根据反应的相关方程式计算. |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
化合物M是一种治疗心脏病的中间体,以A为原料的工业合成路线如下图所示:
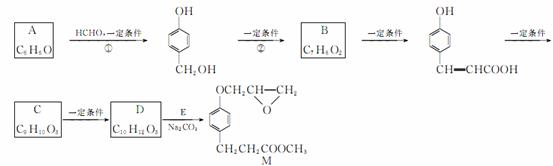
已知:RONa+R′Cl→ROR′+NaCl。
根据题意完成下列填空:
(1)写出反应类型:反应①____________;反应②____________。
(2)写出结构简式:A__________________________;
C__________________________。
(3)写出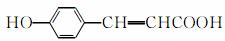 的邻位异构体分子内脱水生成香豆素的结构简式:
的邻位异构体分子内脱水生成香豆素的结构简式:
________________________________________________________________________。
(4)由C生成D的另一个反应物是________,反应条件是
____________________________ _
_ ___________________________________________。
___________________________________________。
(5)写出由D生成M的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(6)A也是制备环己醇(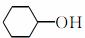 )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
________________________________________________________________________
_____________________________________________________ ___________________。
___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中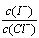 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:
2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
① 根据上述实验结果,该反应的平衡常数K的计算式为:___________。
② 上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________min-1
③ 由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重 新达到平衡,相应的点分别为_________________(填字母)
新达到平衡,相应的点分别为_________________(填字母)

查看答案和解析>>
科目:高中化学 来源: 题型:
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。
A.降低了反应的活化能 B.增大了反应的速率
C.降低了反应的焓变 D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(5)题11图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为 ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
| A. | Na2O与Na2O2都能和水反应生成碱,它们是碱性氧化物 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | Na2O2应保存于密封、干燥带玻璃塞的广口瓶中 | |
| D. | Na2O2可作供氧剂,而Na2O不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用1L 1.0mol•L﹣1 NaOH溶液吸收0.8mol CO2,所得溶液中的CO32﹣和HCO3﹣的浓度之比约是()
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是
2H2(g)+O2(g)===2H2O(l) ΔH=-483.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100 g CaCO3沉淀,则在此条件下完全燃烧1 mol无水乙醇时放出的热量是
( )
A.0.5Q B.Q C.2Q D.5Q
查看答案和解析>>
科目:高中化学 来源: 题型:
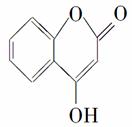 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成。
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成。
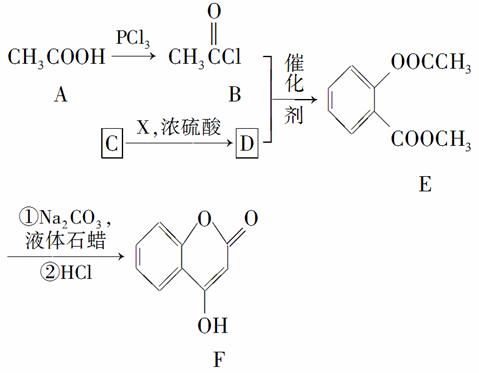
已知:E变成F相当于在E分子中去掉1个X分子。请回答下列问题。
(1)A→B的反应类型是________。
(2)E分子中有________种不同化学环境的氢原子。
(3)X催化氧化可生成一种常温下为气体的物质,写出该气体分子的结构式:________。
(4)写出D→E的化学方程式:________________________。
(5)含酯基且遇FeCl3溶液显紫色,与C互为同分异构体的有机物有________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com