
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图所示实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)回答下列问题:
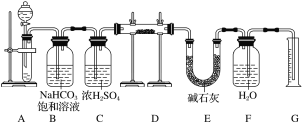
(1)装置A是用来产生CO2气体,则A中液体试剂选用____________,发生反应的离子方程式为___________________。
(2)装置B的作用是_____________________________________________________,装置C的作用是________________________________________________________,装置E中碱石灰的作用是_________________________________________________。
(3)装置D中发生反应的化学方程式为________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
【答案】6 mol/L盐酸 CaCO3+2H+=Ca2++CO2↑+H2O 除去气体中的HCl 干燥气体 吸收装置D中反应剩余的CO2 2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3 78%
【解析】
碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,碳酸氢钠溶液吸收二氧化碳中的氯化氢,浓硫酸吸收水蒸气,干燥的二氧化碳和试样反应,过氧化钠和二氧化碳反应生成碳酸钠和氧气,氧化钠和二氧化碳反应生成碳酸钠,碱石灰吸收反应剩余的二氧化碳,最后用排水测定氧气体积。
(1) 装置A是用来产生CO2气体,用碳酸钙和6 mol/L盐酸反应,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;
(2).装置B中的碳酸氢钠除去气体中的HCl,装置C中的浓硫酸干燥气体 ,装置E中的碱石灰吸收装置D中反应剩余的CO2 ;
(3)装置D中的反应为2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3 ;
(4) 根据方程式2Na2O2+2CO2=2Na2CO3+O2分析,224 mL(标准状况)的氧气的物质的量为0.01mol,则过氧化钠的物质的量为0.02mol,质量为0.02mol×78g/mol=1.56克,纯度为![]() =78%。
=78%。


科目:高中化学 来源: 题型:
【题目】![]() 可用作漂白剂和呼吸面具中的供氧剂。
可用作漂白剂和呼吸面具中的供氧剂。
![]() 某学习小组发现:在盛有
某学习小组发现:在盛有![]() 的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量
的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量![]() 粉末,又有气泡产生。请写出加入
粉末,又有气泡产生。请写出加入![]() 反应的化学方程式为_____________。
反应的化学方程式为_____________。
![]() 有强氧化性,
有强氧化性,![]() 具有还原性,有同学猜想
具有还原性,有同学猜想![]() 与
与![]() 能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
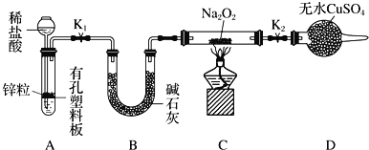
步骤1:按上图组装仪器![]() 图中夹持仪器省略
图中夹持仪器省略![]() ,检查气密性,装入药品。
,检查气密性,装入药品。
步骤2:打开![]() 、
、![]() ,产生的氢气流经装有
,产生的氢气流经装有![]() 的硬质玻璃管,一段时间后,没有任何现象。
的硬质玻璃管,一段时间后,没有任何现象。
步骤3:________________,点燃酒精灯,开始加热,观察到硬质玻璃管内![]() 开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭![]() 。
。
①添加稀盐酸的仪器名称是______________。
②步骤3点燃酒精灯之前必须进行的操作是___________________。
③设置装置D的目的是________________。
④你得到的结论是___________________![]() 若能反应请用化学方程式表示
若能反应请用化学方程式表示![]() 。
。
⑤该实验存在明显的不足之处,应该如何改进___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A. 1∶1 B. 2∶5 C. 3∶2 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr3+基态核外电子排布式为__________。
(2)AlCl3可做反应 的催化剂。
的催化剂。
①乙酸酐分子中发生sp3杂化的原子有_____个。
②1mol对甲基苯乙酮分子中含有σ键的数目为______mol。
③CH3COOH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为________。
④单个AlCl3气态分子的空间构型为_____,AlCl3可与Cl-形成AlCl4-,与AlCl4-互为等电子体的分子为_______。
(3)某遮光剂的晶胞如图所示,由晶胞可知。n=_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
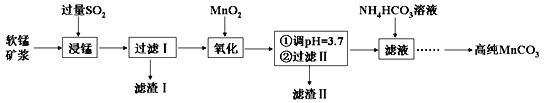
(1)过滤Ⅰ所得滤渣Ⅰ的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:__________________________。
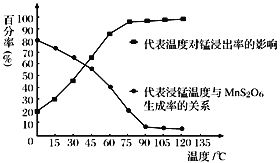
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如右图所示,为减少 MnS2O6 的生成,“浸锰”的适宜温度是_______。
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度控制在30-35℃,温度不宜太高的原因是_______。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
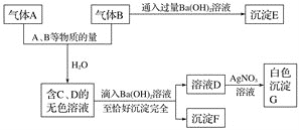
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,可以进行综合利用。从海水中提取淡水、食盐和溴的过程如图:
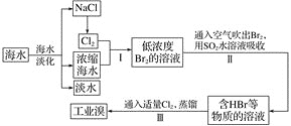
(1)步骤Ⅰ获得Br2的化学反应的离子方程式为_______。
(2)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的,其反应的化学方程式为____。在该反应中,氧化剂是____(填化学式);若反应中生成2mol HBr,则消耗___mol SO2。
(3)根据上述反应可判断出SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭燃料偏二甲肼(CH3)2N-NH2与NO2反应放出巨大的能量,能把500t以上的仪器设备送入太空,这是液体推进剂的优点。
(1)液态偏二甲肼(CH3)2N-NH2与氨气性质相似,易溶于水显弱碱性。易溶于水的原因是_______,写出溶于水后的电离方程式______________。
(2)氨-次氯酸钠法制取偏二甲肼(CH3)2N-NH2原理如下:
反应- NH3+NaClO→NaOH+Cl-NH2
反应二 Cl-NH2+HN(CH3)2→(CH3)2N-NH2+HCl
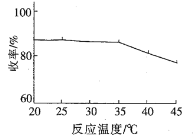
①模拟实验得到温度与收率如下关系图,温度约为_______℃时收率最高,约为________℃以后收率下降,收率下降的主要原因是温度升高,_________挥发所致。
②氯化铵是制取偏二甲肼(CH3)2N-NH2的缓冲剂,模拟实验得到加入氯化铵与收率的关系图如下:
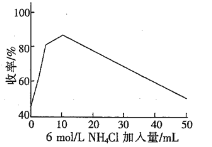
请结合原理知识解释收率升高的原因____________。
(3)固体推进剂如硼铝或纳米铝粉比液体推进剂灌装简单、无需临时加注,但与液体推进剂相比其最大缺点是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com