
| A. | NaHCO3 | B. | Na2CO3 | C. | NaOH | D. | Na2O2 |
分析 钠和空气中的氧气反应生成氧化钠,氧化钠再和水反应生成氢氧化钠,NaOH吸收空气中的水和CO2生成Na2CO3•xH2O,带结晶水的碳酸钠失水生成碳酸钠.
解答 解:Na的性质活泼,易与空气中氧气反应生成Na2O,4Na+O2=2Na2O,Na2O易与水反应生成NaOH,Na2O+H2O=2NaOH,NaOH吸收空气中的水和CO2生成Na2CO3•xH2O,Na2CO3•xH2O风化脱水生成Na2CO3,最终得到的物质是Na2CO3,
故选B.
点评 本题考查了钠及其化合物的性质,明确钠、氧化钠、氢氧化钠、带结晶水的碳酸钠性质即可解答,注意氢氧化钠易潮解、Na2CO3•xH2O易风化,难度不大.


科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
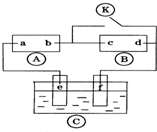 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )| A. | a为直流电源的负极 | B. | d极发生的反应为2H++2e-═H2↑ | ||
| C. | e极发生氧化反应 | D. | f电极为锌板 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物均为酸性氧化物 | |
| B. | 冰醋酸、一水合氨、次氯酸都是弱电解质 | |
| C. | 盐酸、硫酸、硝酸都是强电解质 | |
| D. | 液氨、液氯、液体氯化氢都不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,71g Cl2所含原子数为NA | |
| B. | 标准状况下,22.4L氦气中含有的原子数为2NA | |
| C. | 在非标准状况下,1mol任何气体的体积不可能是22.4L | |
| D. | 常温常压下,32g O2和O3混合气体中含有原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,一定不能自发进行反应 | |
| B. | 已知:CH4(g)+$\frac{3}{2}$O2(g)═2H2O(l)+CO(g)△H,则△H表示CH4的燃烧热 | |
| C. | 恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)?2C(g),充分反应后测得放出的热量为Q kJ,则该反应的△H=-Q kJ/mol | |
| D. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com