
| A、CO2 |
| B、H2O |
| C、N2 |
| D、CCl4 |
 ,满足8电子稳定结构,故C错误;
,满足8电子稳定结构,故C错误;

科目:高中化学 来源: 题型:
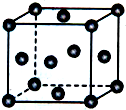 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第二周期,ⅢA族 |
| B、第二周期,ⅦA族 |
| C、第五周期,ⅡA族 |
| D、第七周期,ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
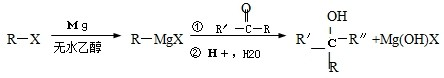
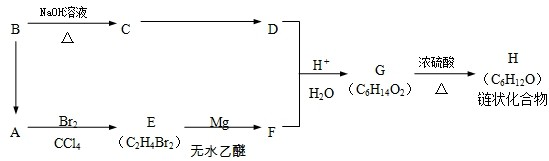
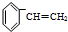 )聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中.写出以D和苯为主要原料制备苯乙烯(
)聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中.写出以D和苯为主要原料制备苯乙烯(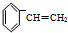 )的合成路线流程图,无机试剂任选.(合成路线常用表示方法为:A
)的合成路线流程图,无机试剂任选.(合成路线常用表示方法为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:

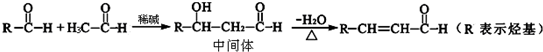
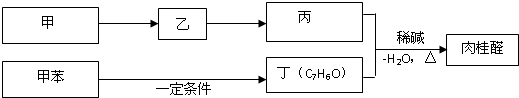
查看答案和解析>>
科目:高中化学 来源: 题型:
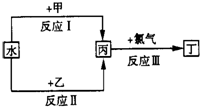
查看答案和解析>>
科目:高中化学 来源: 题型:
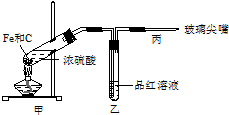 (1)下列仪器在使用前必须检查其是否漏水的是
(1)下列仪器在使用前必须检查其是否漏水的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com