

分析 I.从溶液中提取绿矾经过趁热过滤,去除杂质,冷却结晶析出绿矾晶体,再过滤等操作;Fe与铁离子反应生成亚铁离子;
II.(1)依据氧化还原反应的特征化合价有升必有降来分析;
(3)③分解生成的气体充满装置,不能全部被排出;
④根据检验H2O、SO2、SO3的方法分析;
(4)根据2FeSO4•7H2O~e2O3的关系式可以计算5.56g样品完全分解产生Fe2O3为1.6g,而实际剩余固体为2.32g,说明亚硫酸铁有剩余;
(5)根据实验可知分解产物为H2O、SO2、SO3、Fe2O3;
III.滴定时发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,根据消耗的K2Cr2O7标准溶液的物质的量可以求出Fe2+的物质的量,再求出100mL溶液中Fe2+的物质的量和质量,然后求出质量分数.
解答 解:I.从溶液中提取绿矾经过趁热过滤,去除杂质,冷却结晶析出绿矾晶体,再过滤,冰水洗涤、小心烘干,得到绿矾晶体;Fe与铁离子反应生成亚铁离子,则发生的反应会有:Fe+2Fe3+=3Fe2+;
故答案为:冷却结晶;Fe+2Fe3+=3Fe2+;
II.(1)乙:Fe2O3、SO3、H2O,反应中化合价只有铁升高了,没有元素化合价的降低,不符合氧化还原反应规律,所以乙猜想肯定不成立;
故答案为:乙;
(3)③分解生成的气体充满装置,不能全部被排出,通入N2可以将生成的气体产物全部排出,被后面的试剂完全吸收;
故答案为:将分解产生的气体全部排出;
④B装置中无水硫酸铜变蓝,说明有水生成,C中锥形瓶内产生沉淀,说明有SO3,D中品红溶液褪色,说明有SO2.由此可以证明的产物有 H2O、SO2、SO3;
故答案为:H2O、SO2、SO3;
(4)根据2FeSO4•7H2O~e2O3的关系式可以计算5.56g样品完全分解产生Fe2O3为1.6g,而实际剩余固体为2.32g,剩余的固体的质量偏大,说明亚硫酸铁没有完全分解有剩余,则剩余固体中含有二价铁,所以加入适量硫酸溶解,再滴加少许KMnO4溶液,发现KMnO4溶液紫红色褪去;
故答案为:5.56g样品完全分解产生Fe2O3为1.6g,实验剩余固体为2.32g,说明亚硫酸铁没有分解完或有剩余;
(5)根据实验可知分解产物为H2O、SO2、SO3、Fe2O3,则丁的猜想正确;
故答案为:丁;
III.滴定时发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
n(Cr2O72-)=bmol•L-1×v×10-3L,则n(Fe2+)=6n(Cr2O72-)=6×bmol•L-1×v×10-3L,
所以100mL溶液中Fe2+的物质的量6×bmol•L-1×v×10-3L×$\frac{100mL}{25mL}$,
则该抗贫血药中铁元素的质量分数为$\frac{6×bmol•{L}^{-1}×v×1{0}^{-3}L×\frac{100mL}{25mL}×56g/mol}{ag}$×100%=$\frac{1.344bv}{a}$×100%;
故答案为:$\frac{1.344bv}{a}$×100%.
点评 本题考查了探究物质组成的方法,题目难度较大,试题涉及物质组成的测定、Fe及其化合物的性质、离子方程式、离子的检验方法等知识,试题知识点较多,综合性较强,充分考查了学生灵活应用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
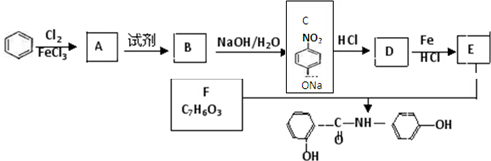
 .
. .
. 、
、 、
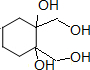
、 (任选两种)(写出各种结构).
(任选两种)(写出各种结构).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用药匙取少许样品于试管中,用滴管滴加适量的3mol•L-1H2SO4溶液,加热,充分反应后得到A溶液 | - |
| 步骤2:取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管 | 若溶液变红色,样品中含+3价的铁元素 |
| 步骤3:另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管 | 若溶液的紫红色褪去,样品中含+2价的铁元素 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

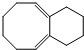 )与乙烯通过烯烃复分解进行如图所示的一系列反应:
)与乙烯通过烯烃复分解进行如图所示的一系列反应: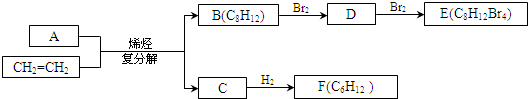
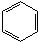 $\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式
$\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式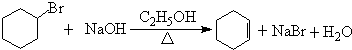

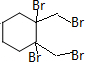 +4KOH
+4KOH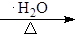
 +4KBr.
+4KBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
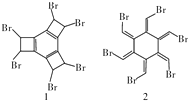
| A. | 有机物1和2互为同分异构体,分子式为C12H6Br6 | |
| B. | 有机物1和2在氢氧化钠的乙醇溶液中均可发生消去反应 | |
| C. | 有机物1和2中所有原子均共平面 | |
| D. | 有机物2能使酸性高锰酸钾溶液褪色,而有机物1不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
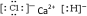 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com