
利用太阳能分解制氢,若光解0.02 mol水,下列说法正确的是
A.可生成H2的质量为0.02g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224L(标准情况)
D.生成H2的量理论上等于0.04mol Na与水反应产生H2的量
科目:高中化学 来源:2015-2016学年湖北省枣阳市高二5月月考化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、Mg2+、Fe2+、Al3+和SO42-五种离子,若向其中加入过量的Ba(OH)2溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )
A.4种 B.3种 C.2种 D.1种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西南宁二十六中高一下学期期中考试化学试卷(解析版) 题型:选择题
下列各组的电极材料和电解液,不能组成原电池的是( )
A.铜片、石墨棒,稀硫酸 B.铜片、石墨棒,硝酸银溶液
C.锌片、铜片,稀盐酸 D.铜片、银片,FeCl3溶液
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(海南卷参考版) 题型:填空题
M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
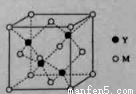
①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(海南卷参考版) 题型:填空题
KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:

(1)为尽量少引入杂质,试剂①应选用___(填标号)。
A.HCl溶液 B.H2SO4溶液 C.氨水 D.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3  AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(海南卷参考版) 题型:选择题
下列叙述错误的是
A.氦气可用于填充飞艇
B.氯化铁可用于硬水的软化
C.石英砂可用于生产单晶硅
D.聚四乙烯可用于厨具表面涂层
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省杭州市七校高一下学期期中化学试卷(解析版) 题型:填空题
甲醇(CH3OH)是一种优质燃料,
(1)已知一定条件下88gCO2和足量氢气完全反应三可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量.请回答:
①该反应的热化学方程式: .
②若生成3mol甲醇放出的热量为 .
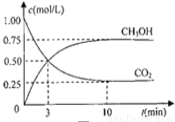
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)= .
②下列措施中能使v(CO2)增大的是 .
A.加入催化剂
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.升高温度
③能够说明该反应已达到平衡的是 .
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度不再变化
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH.
E.有2个C=O键断裂的同时,有3个H-H键断裂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省杭州市七校高一下学期期中化学试卷(解析版) 题型:选择题
下列热化学方程式书写正确的是
A.2SO2 + O2 = 2SO3 △H=-196.6 kJ/mol
B.2H2O (g) =2H2(g)+O2(g) △H=-483.6kJ/mol
C.2H2(g)+O2(g) = 2H2O(l) △H=-571.6 kJ/mol
D.C(s) + O2(g) = CO2(g) △H= +393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省白银市高二下期中化学试卷(解析版) 题型:实验题
某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯,
已知:
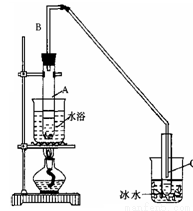
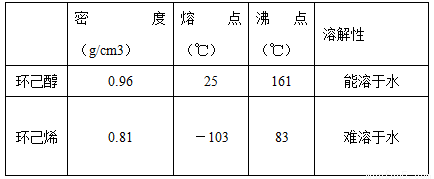
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_______,导管B除了导气外还具有的作用是_________。
②试管C置于冰水浴中的目的是_______________________________________
(2)制备精品
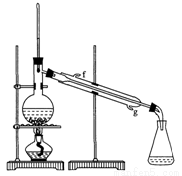
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下” ),分液后用______(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_______口进入。蒸馏时要加入生石灰,目的是________________________。
③收集产品时,控制的温度应在_________℃左右。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com