
科目:高中化学 来源: 题型:
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.30mL | 18.50mL |
| 第二次 | 0.10mL | 18.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
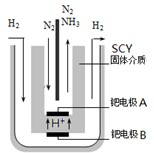 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点 ℃ |
沸点 ℃ |
液态时 密度 g/cm3 |
18℃时在水中的溶解度 mL/L |
乙醚、丙酮 或苯中的 溶解性 |
乙醇 中的 溶解性 |
| -97.73 | -24.2 | 0.9159 | 280 | 互溶 | 能溶 |
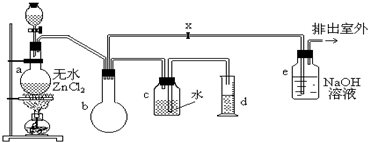
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com