
 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的 倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题: 倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素; 2MgO+C,
2MgO+C, 2MgO+C.
2MgO+C. 倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;

科目:高中化学 来源: 题型:
 有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.
有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D | 其氢氧化物和氧化物都有两性,且与C同周期 |
| E | 与C同周期,其原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
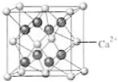 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com