
反应① Fe(s)+CO2(g)===FeO(s)+CO(g);△H1= akJmol-1
反应② CO(g)+1/2O2(g)===CO2(g);△H2= bkJmol-1
测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
(1)反应①的化学平衡常数表达式为 ,a 0(填“>”、“<”或“=”)。 在500℃2L 密闭容器中进行反应①,Fe 和 CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为 ,用CO表示的化学反应速率为 。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900℃ D.使用合适的催化剂
(3)下列图像符合反应①的是 (填序号)(图中v是速率、为混合物中CO的含量,T为温度)。
(4)由反应①和②可求得反应2Fe(s)+O2(g)===2FeO(s) △H3中的△H3= (用含a、b的代数式表示)。
(5)如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
(填“甲醇”或“氧气”),b处电极上发生的电极反应是:
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
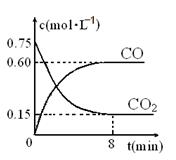
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g) == 2CO2(g);△H=-566 kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6 kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g)== 2CO2(g);△H=-566kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:填空题
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
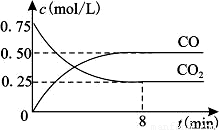
(1)下列措施中能使平衡时K增大的是___________(填序号);
A.升高温度??? B.增大压强C.充入一定量COD.降低温度
(2)8分钟内,CO的平均反应速率v(CO)=___________mol/(L·min);
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
容器 | 甲 | 乙 |
反应物投入量 | 3molFe、2molCO2 | 4molFeO、3molCO |
CO的浓度(mol/L) | C1 | C2 |
CO2的体积分数 |
|
|
体系压强(Pa) | P1 | P2 |
气态反应物的转化率 |
|
|
①下列说法正确的是___________;
A.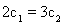 B.
B.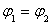 C.P1<P2D.
C.P1<P2D.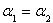
②求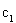 =___________、
=___________、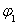 =___________、
=___________、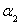 =___________。
=___________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三高考仿真训练题(理综)化学部分 题型:填空题
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。

(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”),该反应的平衡常数K= ,温度升高,K (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
(6)已知Ksp(Fe(OH)3)= 8´10-38,某溶液中含有Fe3的浓度是0.05mol×L-1。如果要使Fe(OH)3沉淀完全pH至少为 (溶液中离子浓度小于1×10-5mol/L时,沉淀完全,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源:2012届广东省高二下学期期中考试化学试卷 题型:填空题
(13分)一定条件下铁可以和CO2发生反应: Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。

(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeCl3溶液可用于天然气脱硫,写FeCl3溶液与天然气中H2S反应的离子方程式:
。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com