
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| B | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊不消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊;再加入品红溶液,溶液为红色 | Ca(ClO)2溶液 |
| D | 通入SO2,溶液没有明显变化;再通入氨气,溶液变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化钙与二氧化碳反应生成碳酸钙沉淀,二氧化碳过量时碳酸钙沉淀溶解,再加入氢氧化钠溶液后碳酸氢钙又转化成碳酸钙沉淀;
B.硅酸钠与二氧化碳反应生成硅酸沉淀,硅酸不与二氧化碳反应;
C.次氯酸能够漂白品红溶液;
D.二氧化硫不与氯化钙溶液反应,但通入氨气后二氧化硫与氨气反应生成亚硫酸铵,亚硫酸铵与氯化钙生成亚硫酸钙沉淀.
解答 解:A.向Ca(OH)2溶液中通入CO2,先生成碳酸钙,继续通CO2至过量,生成碳酸氢钙,沉淀消失,碳酸氢钙与NaOH溶液反应生成碳酸钙沉淀,“操作及现象”与“溶液”对应关系合理,故A不选;
B.向Na2SiO3溶液中通入CO2,生成硅酸沉淀,继续通入二氧化碳,沉淀不消失,“操作及现象”与“溶液”对应关系合理,故B不选;
C.向Ca(ClO)2溶液中通入CO2,生成碳酸钙和次氯酸,次氯酸具有漂白作用,可使品红褪色,“操作及现象”与“溶液”对应关系不合理,故C选;
D.CaCl2溶液通入SO2,二者不反应,则溶液没有明显变化;再通入氨气,氨气与二氧化硫生成亚硫酸铵,亚硫酸铵与钙离子生成亚硫酸钙沉淀,溶液变浑浊,“操作及现象”与“溶液”对应关系合理,故D不选;
故选C.
点评 本题考查化学实验方案的评价,题目难度中等,明确离子反应发生条件为解答关键,注意熟练掌握常见元素及其化合物性质,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
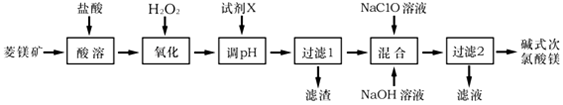
 ,它的作用是将Fe2+氧化为Fe3+.
,它的作用是将Fe2+氧化为Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
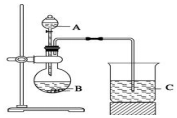 一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验
一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 保证食品安全、保持营养均衡、合理用药是保障人体健康的基础.
保证食品安全、保持营养均衡、合理用药是保障人体健康的基础.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
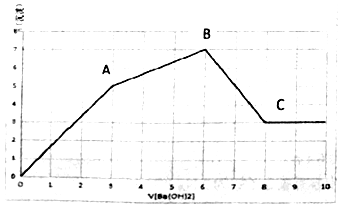 向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )| A. | OA段反应的离子方程式为Al3++3OH-+Ba2++SO42-=Al(OH)3↓+BaSO4↓ | |
| B. | B点对应的溶液中,Na+、CO32-、NO3-可以大量共存 | |
| C. | C点对应的溶液中,通入过量的CO2气体有白色沉淀生成 | |
| D. | 原溶液中Al2(SO4)3和AlCl3的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
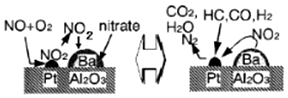
| A. | 该机理研究的是汽车尾气催化转化机理 | |
| B. | CO在催化剂表面被还原生成CO2,铂起催化作用 | |
| C. | CO在催化剂表面可能和O2、NO反应 | |
| D. | NO、CO均能与人体中的血红蛋白结合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com