
 苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下:
苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下: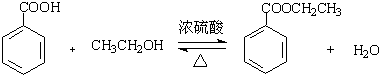 .
.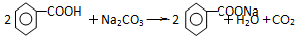 .
.分析 (1)苯甲酸与乙醇在浓硫酸加热条件下反应生成苯甲酸乙酯;
(2)步骤②为检查装置的气密性,方法为:关闭旋塞,向分水器中加一定量的水,形成一段水柱,静置,若液面不下降,则气密性良好;
(3)根据制备苯甲酸乙酯的反应分析,不断分离出水可以促进反应向正反应方向移动;
(4)根据沸石可以防止液体暴沸;无水CaCl2可以作干燥剂吸收水分分析;
(5)饱和Na2CO3溶液与苯甲酸发生反应,从而除去苯甲酸;
(6)用pH试纸测定溶液pH的方法为:用玻璃棒蘸取少许待测液滴在PH试纸上,然后把试纸显示的颜色与标准比色卡对照,即可确定溶液的酸碱度,切记不能直接把试纸浸入待测液中,也不能先用水将pH试纸润湿后测定,因为这样做会稀释待测液,使测量结果不准.
解答 解:(1)苯甲酸与乙醇在浓硫酸加热条件下反应生成苯甲酸乙酯,化学方程式为: ;故答案为:
;故答案为: ;
;
(2)步骤②为检查装置的气密性,方法为:关闭旋塞,向分水器中加一定量的水,形成一段水柱,静置,若液面不下降,则气密性良好,故答案为:关闭旋塞,向分水器中加一定量的水,形成一段水柱,静置,若液面不下降,则气密性良好;
(3)制备苯甲酸乙酯的反应为可逆反应,分离器分离出生成的水,减少生成物从而使该反应向正反应方向移动,提高转化率,故答案为:使化学平衡正向移动,提高反应物的转化率;
(4)沸石的作用是防止液体暴沸;步骤⑥中无水CaCl2的作用除掉产品中微量的水分杂质;故答案为:防止液体暴沸;除掉产品中微量的水分杂质;
(5)步骤④加入饱和Na2CO3溶液与苯甲酸发生反应生成苯甲酸钠溶于水溶液而除去,方程式为: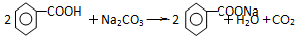 ;故答案为:
;故答案为: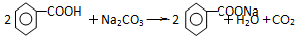 ;
;
(6)测定溶液pH值的方法是将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值,故答案为:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值.
点评 本题考查了有机实验方案的设计,明确实验原理是解本题关键,侧重分析能力及物质除杂的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | 光导纤维具有很强的导电能力,应用于制造通信光缆 | |
| C. | 过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水 | |
| D. | FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
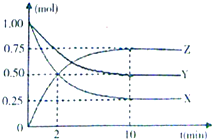 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a<b<2a | C. | 2a=b | D. | 2a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
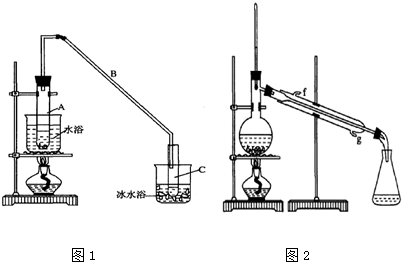

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)良好的生态环境可以提升生活质量.
(1)良好的生态环境可以提升生活质量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
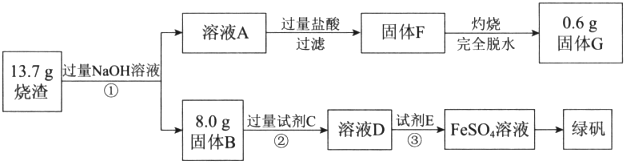
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ②③ | C. | ④⑤ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32克O2所含的原子数目为2NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com