
| A. | r(Na+)>r(Na) | B. | r(Cl)>r(Cl-) | C. | r(Na)>r(Mg) | D. | r(F)>r(Cl) |
分析 阳离子半径小于相应原子半径,阴离子半径大于相应原子半径,同周期自左而右原子半径减小,同主族自上而下原子半径增大.
解答 解:A.原子形成阳离子失去电子层,阳离子半径半径小于相应的原子半径,故离子半径:r(Na+)<r(Na),故A错误;
B.原子获得电子形成阴离子,电子层不变,但核外电子增大,核外电子排斥增大,阴离子半径大于相应原子半径,故离子半径:r(Cl)<r(Cl-),故B错误;
C.同周期自左而右,核电荷数增大,原子半径减小,故原子半径r(Na)>r(Mg),故C正确;
D.同主族自上而下电子层增多,原子半径增大,故原子半径r(F)<r(Cl),故D错误.
故选:C.
点评 本题考查微粒半径的比较,比较基础,理解掌握微粒半径比较规律,有利于基础知识的巩固.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
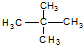 和
和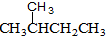 ⑧CH4和CH3CH3
⑧CH4和CH3CH3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要 +H2O+H2SO4$\stackrel{100-130℃}{→}$
+H2O+H2SO4$\stackrel{100-130℃}{→}$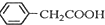 +NH4HSO4
+NH4HSO4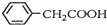 +Cu(OH)2→(
+Cu(OH)2→(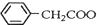 )2Cu+H2O
)2Cu+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
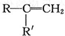 $→_{②酸化}^{①KMnO_{4}/OH-}$
$→_{②酸化}^{①KMnO_{4}/OH-}$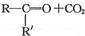 (R、R′可表示烃基或官能团)A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
(R、R′可表示烃基或官能团)A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
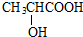 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O,其反应类型是消去反应.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O,其反应类型是消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
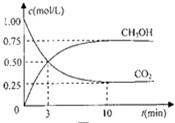 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ④ | D. | 均不符合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去溴苯中的溴,可加入过量的KI溶液后分液 | |
| B. | 葡萄糖、蔗糖都能与新制氢氧化铜浊液发生反应 | |
| C. | 蛋白质水解的最终产物既能和强酸反应,又能和强碱反应 | |
| D. | 纤维素属于高分子化合物,与淀粉互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com