
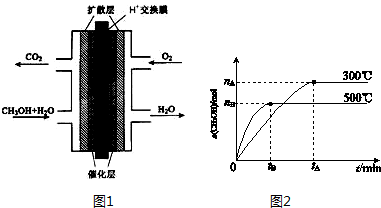
分析 Ⅰ.(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反应②;
(3)甲醇燃料电池中,甲醇为负极,正极发生还原反应,电极反应式为:O2+4H++4e-═2H2O;
Ⅱ.(1)根据化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,列出平衡常数的表达式;根据升高温度乙醇的物质的量减小,平衡逆向移动,判断平衡常数的变化;
(2)根据化学反应速率是υ(H2)=2υ(CH3OH)计算;
(3)达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变;
(4)将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,反应速率增大,平衡向正反应方向移动,以此判断.
解答 解:Ⅰ.(1)在25℃、101kPa下,1mol CH3OH液体完全燃烧生成CO2和液态水时放出热量726.51kJ,则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1;
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反应②,则△H2=+49.0kJ•mol-1+(-241.8kJ•mol-1)=-192.8kJ•mol-1,故答案为:-192.8;
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,正极发生还原反应,电极反应式为:O2+4H++4e-═2H2O,故答案为:负;O2+4H++4e-═2H2O;Ⅱ.(1)化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,反应物的生成物都是气体,故平衡常数表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,由图象可知升高温度乙醇的物质的量减少,平衡向逆反应方向移动,K减小,
故答案为:$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;减小;
(2)υ(CH3OH)=$\frac{{n}_{B}}{{n}_{t}×3L}$mol/(L.min),故υ(H2)=2υ(CH3OH)=$\frac{2{n}_{B}}{3{t}_{B}}$mol/(L.min),故答案为:$\frac{2{n}_{B}}{3{t}_{B}}$mol/(L.min);
(3)达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变,在体积不变时,气体的密度不变,不能作为判断是否达到平衡状态的依据,
故答案为:c、d;
(4)将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正逆反应速率都增大,平衡向正反应方向移动,CH3OH的物质的量增加,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,故有c(H2)/c(CH3OH)减小,
故答案为:c、d.
点评 本题考查化学平衡的影响因素和化学平衡的标志等问题,题目难度中等,注意外界条件对化学平衡移动的影响以及平衡状态的判断角度.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质(括号中为杂志) | 所加试剂 | 操作方法 |
| 酒精(水) | 新制生石灰 | 蒸馏 |
苯甲酸(沙子) | / | 过滤 |
| 甲烷(乙烯) | 溴水(溴的四氯化碳溶液) | 洗气 |
| 溴苯(溴) | 氢氧化钠溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 丙分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |

 $→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定条件}$乙 (注明反应条件).
(注明反应条件).
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,W是否存在顺反异构?否 (填“是”或“否”).
,W是否存在顺反异构?否 (填“是”或“否”). 是W与水在一定条件下发生加成反应的产物的同系物.
是W与水在一定条件下发生加成反应的产物的同系物. +2Na→
+2Na→ +H2↑.
+H2↑. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解池的阳极发生氧化反应,阴极上发生还原反应 | |
| B. | 不能自发进行的氧化还原反应可通过电解的原理实现 | |
| C. | 电镀时,电镀池里的阳极材料发生氧化反应 | |
| D. | 电解饱和食盐水时,阳极得到,NaOH溶液和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com