
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
分析 A.煤的气化、液化都是化学变化;
B.油脂碱性条件下水解,可生成肥皂;
C.碳纤维是碳的单质;
D.聚氯乙烯添加的增塑剂、防老剂等主要辅料有毒性.
解答 解:A.煤的气化是煤在氧气不足的条件下进行部分氧化形成H2、CO等气体的过程,煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品的过程,所以煤经过气化和液化等变化是化学变化,故A错误;
B.地沟油的主要成分是油脂,油脂碱性条件下水解成为造化反应,可生成肥皂,故B正确;
C.合成纤维、人造纤维都属于有机高分子材料,碳纤维是碳的单质,不属于有机高分子材料,故C错误;
D.聚氯乙烯也是经常使用的一种塑料,它是由聚氯乙烯树脂、增塑剂和防老剂组成的树脂,本身并无毒性.但所添加的增塑剂、防老剂等主要辅料有毒性,日用聚氯乙烯塑料中的增塑剂,主要使用对苯二甲酸二丁酯、邻苯二甲酸二辛酯等,这些化学品都有毒性,聚氯乙烯的防老剂硬脂酸铅盐也是有毒的,故D错误.
故选B.
点评 本题主要考查了生活的化学相关的知识,掌握煤的气化和液化、有机高分子材料等知识是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在pH=1溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 在含有大量CO32-溶液中:NH4+、Na+、Cl-、H+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在强碱溶液中:Na+、K+、CO32-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
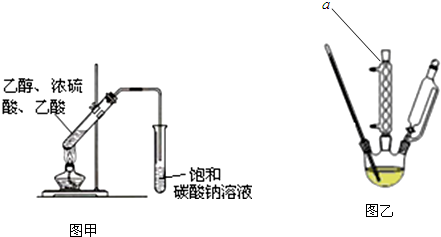
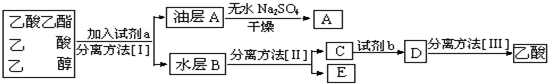
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 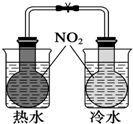 证明温度对平衡移动的影响 | B. | 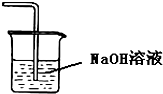 吸收HCl尾气 | ||
| C. | 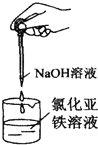 制备氢氧化亚铁 | D. | 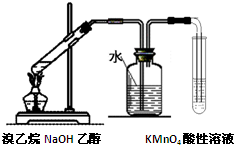 验证溴乙烷消去反应生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 总反应可表示为2SO2+O2+2H2O$\stackrel{NO_{2}}{→}$2H2SO4 | |
| B. | 还可能发生的反应有4NO2+O2+2H2O→4HNO3 | |
| C. | NO2由反应N2+O2$\stackrel{放电}{→}$NO2生成 | |
| D. | 还可能发生的反应有4NO+3O2+2H2O→4HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Br-、SO42- | |
| B. | Al3+、Cl-、OH-、HCO3- | |
| C. | pH=0的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3COO-、SO42-、Na+、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com