
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-1366.8)kJ•mol-1 | |
| B. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+1366.8)kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-151.9)kJ•mol-1 | |
| D. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+151.9)kJ•mol-1 |
分析 乙醇的燃烧热是1366.8kJ•mol-1,1mol乙醇完全燃烧生成温度氧化物二氧化碳和液态水放出的热量,完全燃烧1mol这种乙醇汽油生成液态水时放出的热量为Q kJ.测得该汽油中乙醇与汽油的物质的量之比为l:9.则汽油烃燃烧放热依据组成比和反应放热计算得到,依据热化学方程式书写方法写出.
解答 解:燃烧热是1mol可燃物完全燃烧生成温度氧化物放出的热量,完全燃烧1mol这种乙醇汽油生成液态水时放出的热量为Q kJ,汽油中乙醇与汽油的物质的量之比为l:9,设乙醇物质的量为x,则汽油物质的量为9x,得到10x=1mol,x=0.1mol,因此得到汽油物质的量为0.9mol,设汽油完全燃烧放热Y,反应放热关系为:0.1mol×1366.8kJ•mol-1+0.9×Y=Q,计算得到Y=$\frac{Q-1366.8kJ•mo{l}^{-1}}{0.9}$=$\frac{10Q}{9}-151.9$,反应的热化学方程式为:CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=-($\frac{10Q}{9}$-151.9)kJ•mol-1=(-$\frac{10Q}{9}$+151.9)kJ•mol-1.
故选D.
点评 本题考查了热化学方程式书写和计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
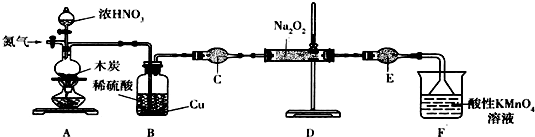
| 次数 | 2 | 3 | ||
| KMnO体积/m | 20.60 | 20.02 | 20.00 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
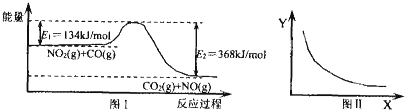
| A. | 该反应的焓变△H=+234 kJ•mol-1 | |
| B. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 | |
| C. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| D. | 若X表示反应时间,则Y表示的可能是混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
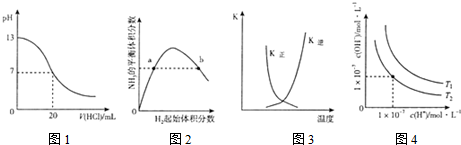
| A. | 图1表示25℃时,用0.lmol L-1盐酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图2表示一定条件下的合成氨反应中.NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点 | |
| C. | 图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图4表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
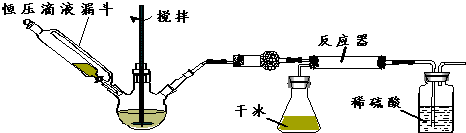
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
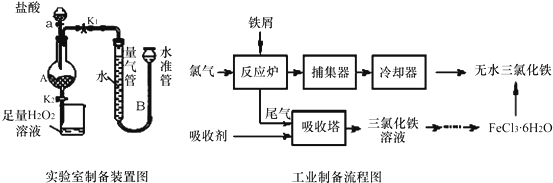
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
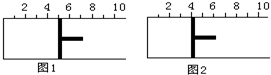 如图所示,一定条件下将lmolA气体和3molB气体充入一个体积可变的密闭容器中,可滑动活塞的位置图1所示.在恒温恒压下发生A(g)+3B(g)?2C(g),当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率为( )
如图所示,一定条件下将lmolA气体和3molB气体充入一个体积可变的密闭容器中,可滑动活塞的位置图1所示.在恒温恒压下发生A(g)+3B(g)?2C(g),当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率为( )| A. | 20% | B. | 40% | C. | 50% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数 | B. | 压强 | C. | 密度 | D. | 平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com