
�״���Դ�ḻ���۸�������������淽�㣬��һ����Ҫ�Ļ���ԭ�ϣ�������Ҫ����;��Ӧ��ǰ����
��1����ҵ�����״��ij��÷����ǣ�CO(g)+2H2(g)  CH3OH(g) ��H����90.8 kJ/mol ��
CH3OH(g) ��H����90.8 kJ/mol ��
��֪��2H2(g)+ O2(g)= 2H2O (l) ��H����571.6 kJ/mol ��
H2(g) +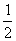 O2(g) = H2O(g) ��H����241.8 kJ/mol ��
O2(g) = H2O(g) ��H����241.8 kJ/mol ��
��H2��ȼ����Ϊ �� kJ/mol��
��CH3OH(g)��O2(g)  CO(g)��2H2O(g)�ķ�Ӧ�ȡ�H�� �� kJ/mol��
CO(g)��2H2O(g)�ķ�Ӧ�ȡ�H�� �� kJ/mol��
�����ں��º��ݵ������ڽ��з�ӦCO(g)+2H2(g)  CH3OH(g)����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־�� �� ��������ĸ��
CH3OH(g)����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־�� �� ��������ĸ��
A��CO�ٷֺ������ֲ��� B��������H2Ũ����COŨ�����
C�������л��������ܶȱ��ֲ��� D��H2������������CH3OH�������������
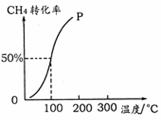 ��2����1.0 mol CH4��2.0 mol H2O ( g )ͨ���ݻ�Ϊ100 L�ķ�Ӧ�ң���һ�������·�����Ӧ��CH4 ( g ) + H2O ( g ) ��CO ( g ) + 3H2 ( g ) �������һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ����ͼ��
��2����1.0 mol CH4��2.0 mol H2O ( g )ͨ���ݻ�Ϊ100 L�ķ�Ӧ�ң���һ�������·�����Ӧ��CH4 ( g ) + H2O ( g ) ��CO ( g ) + 3H2 ( g ) �������һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ����ͼ��
�ټ���100 ��ʱ�ﵽƽ�������ʱ��Ϊ5 min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ �� ��
��100��ʱ��ӦI��ƽ�ⳣ��Ϊ �� ��
��3����ҵ�����ü״��Ʊ������ij��÷��������֣�
�ټ״��������������÷��е�һ����Ҫ��ӦΪCH3OH(g)  CO(g)��2H2(g)���˷�Ӧ���Է����е�ԭ���� �� ��
CO(g)��2H2(g)���˷�Ӧ���Է����е�ԭ���� �� ��
�ڼ״���������������һ���¶�����Ag/CeO2��ZnOΪ����ʱԭ���������Է�Ӧ��ѡ���ԣ�ѡ����Խ��ʾ���ɵĸ�����Խ�ࣩӰ���ϵ��ͼ��ʾ��

��n(O2)/n(CH3OH)��0.25ʱ��CH3OH��O2��������Ҫ��Ӧ����ʽΪ
�� ��
���Ʊ�H2ʱ��ÿ���n(O2)/n(CH3OH)�� �� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ԫ�����ڱ��н���Ԫ����ǽ���Ԫ�صķֽ��߸�����һЩԪ����������
A���Ͻ� B���뵼�� C������ D��ũҩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и������Ļ���ֻҪ������һ���������������ϣ���ȫȼ�պ����ɵ�CO2��H2O���Ǻ�������(����)
A��C2H2��C2H4 B��C2H4��C4H6 C��C2H6��C3H6 D��C6H6��C2H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
21�������ѵ����͡���800�桫1 000��ʱ���TiO2���Ƶ��ѣ�װ������ͼ��ʾ������������ȷ����
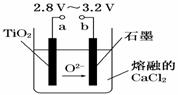 A��aΪ��Դ������
A��aΪ��Դ������
B��ʯī�缫�Ϸ�����ԭ��Ӧ
C�����������ķ�ӦΪ��TiO2��4e��===Ti��2O2��
D��ÿ����0.1 mol�ѣ�ת�Ƶ���0.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ᱵ�����ǵ����մ�Ԫ��������Ҫ����ԭ�ϡ���ҵ�Բ����ι���������ò������ѱ�����[BaTiO(C2O4)2��4H2O]�����տɻ�����ᱵ���塣
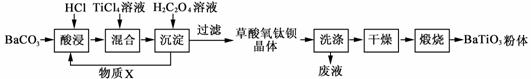
��1�����ʱ�����ķ�Ӧ�����ӷ���ʽΪ �� ��Ϊ���BaCO3������ʣ��ɲ�ȡ�Ĵ�ʩΪ �� ���δ�һ�㣩��
��2�����ղ������ѱ�����[BaTiO(C2O4)2��4H2O]�õ�BaTiO3��ͬʱ�����ɸ����µ����������CO�� �� �� �� ��
��3������H2C2O4��Һʱ��������Ӧ�Ļ�ѧ����ʽΪ �� ��
��ѭ��ʹ�õ�����X�� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������������������ʷ�Ӧ��ת�Ƶĵ��������ٵ��ǣ�������
| �� | A�� | ���NaOH��Һ | B�� | SO2��ˮ��Һ | C�� | FeCl2��Һ | D�� | ͭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪������Ԫ�ص�����aA2+��bB+��cC3-��dD-��������ͬ�ĵ��Ӳ�ṹ��������������ȷ���� �� ��
A ԭ�Ӱ뾶A>B>D>C B ԭ������d>c>b>a
C ���Ӱ뾶C>D>B>A D ���ʵĻ�ԭ��A>B>D>C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��״�������ֵ����ʵ����Ŀ�ȼ���干1.68L������һ����������������������ȫȼ�ա���������ͨ����������ʯ��ˮ���õ��İ�ɫ��������Ϊ15.0g������������ʯ������ȼ�ղ������9.3g���������ֻ���������Ϊ
A��H2��C2H4 �£�CO��C2H4 �ã�H2��C4H6 D��CO ��C3��6
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com