
 用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸,其具体实验步骤如下:
用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸,其具体实验步骤如下:| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 1.00mL | 25.02mL |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| 0.100mol/L×24.00mL |
| 25.00mL |
| V(标准)×c(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
| A、△H1>△H2>△H3 |
| B、△H1<△H3<△H2 |
| C、△H1=△H3>△H2 |
| D、△H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
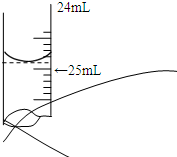 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol?L-1 HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 25.02 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 25.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HO-CH2-CH2-OH |
B、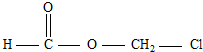 |
C、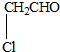 |
D、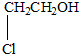 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32? |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42? |
| C、加入氯水后再加入KSCN溶液,溶液变红色,一定有Fe2+ |
| D、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碘含量(以I计) | 符合(20~50)mg/kg的标准 |
| 配 料 | 天然海盐 碘酸钾 |
| 保 质 期 | 密封包装24个月 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com