
已知0.01 mol·L-1的某一元弱酸的pH=4,则它的电离平衡常数为_____。
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
A.打开盛装NO的集气瓶;冷却NO2气体
B.用冰水混合物冷却SO3气体;加热氯化铵晶体
C.木炭吸附NO2气体;将氯气通入品红溶液中
D.向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)===FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l)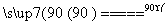 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
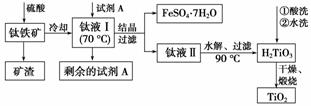
①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2收率降低,原因是________________________________________________________________________
________________________________________________________________________。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将100 mL 6 mol·L-1的HCl与过量Zn粉反应,在一定温度下,为了减缓反应速率,但又不影响生成H2的总量,可向反应物中加入适量的( )
A.Na2CO3固体 B.水
C.CH3COONa固体 D.(NH4)2SO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
关于强、弱电解质的有关叙述错误的是( )
A.强电解质在溶液中完全电离成阴、阳离子
B.在溶液中,导电能力强的电解质是强电解质
C.弱电解质在溶液中以阴、阳离子形式存在
D.纯净的强电解质在液态时,有的导电,有的不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
键能也可以用于估算化学反应的反应热(ΔH),下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/(kJ·mol-1) | 172 | 335 | 498 | X |
已知白磷及完全燃烧后的产物结构如下图
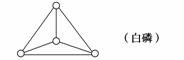
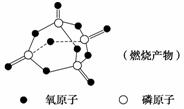
经测定1 mol白磷完全燃烧时,释放2 378 kJ的能量,则上表中X=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在 2Na2O2+2CO2===2Na2CO3+O2反应中,
(1)请在此方程上用双线桥法标出电子转移的方向和数目。___________________ 。
(2) 是还原剂, 是氧化剂。
(3)若转移3mol电子,则所产生的氧气在标准状况下的体积为 ____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com