
下列液体,一定呈中性的是( )
|
| A. | C(H+)=1×10﹣7mol•L﹣1的溶液 |
|
| B. | pH=7的液体 |
|
| C. | C(H+)=C(OH﹣)=1×10﹣6mol•L﹣1的溶液 |
|
| D. | pH=6的水 |
考点:
水的电离;pH的简单计算.
专题:
电离平衡与溶液的pH专题.
分析:
溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,当溶液中c(H+)>c(OH﹣)时,溶液呈酸性;当c(H+)=c(OH﹣)时,溶液呈中性;当溶液中c(H+)<c(OH﹣)时,溶液呈碱性,注意不能根据溶液的PH值大小判断.
解答:
解:A、c(H+)=10﹣7mol•L﹣1的溶液,溶液的pH=7,pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是10﹣12,当PH=6时溶液呈中性,当PH=7时溶液呈碱性,故A错误;
B、温度不知,可能酸性,中性,碱性,故B错误;
C、满足c(H+)=c(OH﹣)=1×10﹣6mol•L﹣1的溶液一定为中性溶液,故C正确;
D、pH=6的水,是中性,故D正确;
故选CD.
点评:
本题考查了水的电离、溶液pH的计算计算,题目难度中等,注意掌握溶液酸碱性的判断方法,明确溶液酸碱性取决于氢离子与氢氧根离子浓度大小.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
|
| A. | Cu与浓硝酸的反应:Cu+2H+═Cu2++H2↑ |
|
| B. | FeCl2溶液与Cl2的反应:Fe2++Cl2═Fe3++2Cl﹣ |
|
| C. | H2SO4溶液与KOH溶液的反应:H++OH﹣═H2O |
|
| D. | CuCl2溶液与NaOH溶液的反应:CuCl2+2OH﹣═Cu(OH)2↓+2Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在一定温度下的AgCl水溶液中,Ag+和Cl﹣浓度的乘积是一个常数 |
|
| B. | AgCl的Ksp=1.8×10﹣10 mol2•L﹣2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl﹣)且Ag+与Cl﹣浓度的乘积等于1.8×10﹣10 mol2•L﹣2 |
|
| C. | 温度一定时,当溶液中Ag+和Cl﹣浓度的乘积等于Ksp值时,此溶液为 AgCl的饱和溶液 |
|
| D. | 向饱和AgCl水溶液中加入少量盐酸,Ksp值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
|
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能够说明亚硝酸(HNO2)为弱电解质的是( )
|
| A. | 0.1mol/L的亚硝酸水溶液的PH=2.1 |
|
| B. | 亚硝酸不与硫酸钠溶液反应 |
|
| C. | 25℃时,HNO2的水溶液的PH<7 |
|
| D. | 用亚硝酸做导电实验时,灯泡很暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为有CuCl2的水溶液中存在如下平衡:
[Cu(H2O)4]2++4Cl﹣⇌[CuCl4]2﹣+4H2O
蓝色 黄色
现欲使溶液由黄色变成蓝色,请写出一种可采用的方法: .
(2)在2SO2+O2⇌2SO3的平衡体系中,用由18O构成的氧气(18O2)替换掉一部分O2,平衡不发生移动.一段时间后SO2中18O的含量 (填增加、减少或不变),其原因是 .
(3)在恒温恒容的两个密闭容器A和B中,分别加入 a mol 和 b mol 的HI(a>b),发生反应:2HI(g)⇌H2(g)+I2(g)达到平衡后.回答下列问题(用“>”、“<”或“=”填空):
①从反应开始到达到平衡所需要时间:tA tB
②平衡时的碘的浓度:cA(I2) cB(I2)
③HI的平衡转化率:αA αB.
查看答案和解析>>
科目:高中化学 来源: 题型:
对某酸性溶液(可能含有Br﹣,SO42﹣,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸.
对于下列物质不能确认其在原溶液中是否存在的是()
A. Br﹣ B. SO42﹣ C. H2SO3 D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是 (用字母代号填).
A.Fe; B.FeCl3; C.FeSO4; D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是 nm.
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: .某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是 ,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05g.溶液中c(Cl﹣)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是B.
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+;
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+.
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
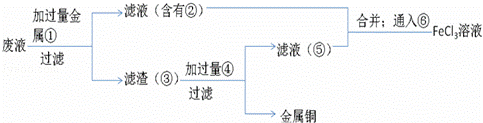
A.请写出上述实验中加入或生成的有关物质的化学式:
① ;② ;③ ;④HCl.
B.请写出通入⑥的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某容器中充入H2和N2,在一定条件下合成NH3,下列叙述不正确的是( )
A.开始反应时,正反应的速率最大
B.随着反应的进行,正反应的速率逐渐减小,最终减小为零
C.随着反应的进行,逆反应的速率逐渐增大,后保持不变
D.随着反应的进行,正反应的速率逐渐减小,最终与逆反应的速率相等且保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com